Descubre qué obtenemos al sumar protones y neutrones
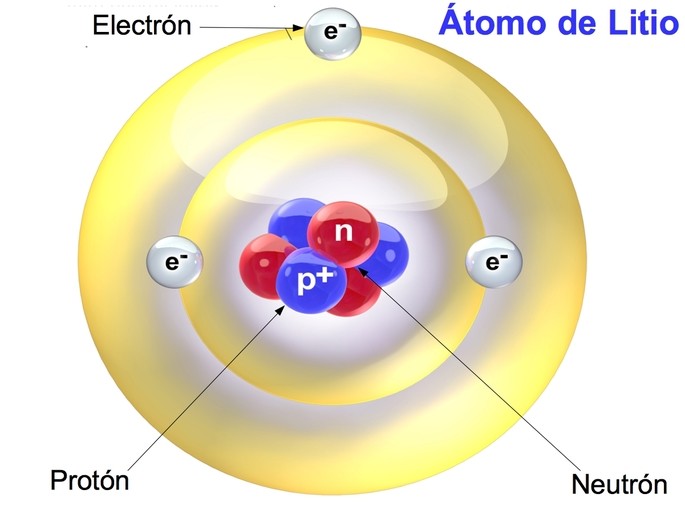
Cuando se trata de entender la estructura de los átomos, es importante comprender la función de los protones y neutrones. Los protones tienen una carga positiva, mientras que los neutrones no tienen carga. Juntos, estos dos componentes forman el núcleo del átomo. Pero, ¿qué sucede cuando sumamos los protones y neutrones? En este artículo, exploraremos qué obtenemos al sumar estos dos componentes y su importancia.
¿Qué son los protones y neutrones?
Los protones y neutrones son partículas subatómicas que se encuentran en el núcleo de los átomos. Los protones tienen una carga positiva y los neutrones no tienen carga. Juntos, estos dos componentes forman el núcleo del átomo.
Protones
Los protones son partículas subatómicas que tienen una carga positiva. Estas partículas se encuentran en el núcleo del átomo y su número determina el elemento químico al que pertenece el átomo. Por ejemplo, el hidrógeno tiene un solo protón, mientras que el carbono tiene seis protones.
Neutrones
Los neutrones son partículas subatómicas que no tienen carga. Estas partículas también se encuentran en el núcleo del átomo y su número puede variar en diferentes átomos del mismo elemento químico. Por ejemplo, el carbono puede tener seis, siete u ocho neutrones.
¿Qué obtenemos al sumar protones y neutrones?
Cuando sumamos el número de protones y neutrones en el núcleo de un átomo, obtenemos la masa atómica de ese átomo. La masa atómica se mide en unidades de masa atómica (uma) y se representa mediante el símbolo "u". Por ejemplo, el hidrógeno tiene una masa atómica de aproximadamente 1 u, mientras que el carbono tiene una masa atómica de aproximadamente 12 u.
¿Por qué es importante la masa atómica?
La masa atómica es importante porque nos ayuda a determinar la cantidad de materia en un átomo. También nos permite comparar la masa de diferentes átomos y compuestos. Por ejemplo, si queremos saber cuántos átomos hay en una muestra de un compuesto, podemos utilizar la masa atómica para calcular la cantidad de átomos presentes.
¿Cómo se calcula la masa atómica?
La masa atómica se calcula sumando el número de protones y neutrones en el núcleo de un átomo. Es importante tener en cuenta que la masa atómica no es un número entero porque algunos átomos tienen isótopos, que son átomos del mismo elemento químico pero con diferentes números de neutrones. Por lo tanto, la masa atómica se calcula como un promedio ponderado de los isótopos de ese elemento químico.
¿Qué pasa si cambiamos el número de protones o neutrones?
Si cambiamos el número de protones en un átomo, entonces estamos cambiando el elemento químico al que pertenece ese átomo. Por ejemplo, si cambiamos el número de protones en un átomo de carbono, podemos obtener un átomo de nitrógeno o de oxígeno.
Si cambiamos el número de neutrones en un átomo, entonces estamos creando un isótopo diferente de ese elemento químico. Por ejemplo, el carbono-12 y el carbono-14 son isótopos del carbono que tienen diferentes números de neutrones.
Conclusión
Los protones y neutrones son componentes clave de los átomos y juntos forman el núcleo del átomo. Al sumar el número de protones y neutrones, obtenemos la masa atómica del átomo. La masa atómica es importante porque nos ayuda a determinar la cantidad de materia en un átomo y nos permite comparar la masa de diferentes átomos y compuestos. Es importante tener en cuenta que si cambiamos el número de protones o neutrones en un átomo, estamos cambiando el elemento químico al que pertenece ese átomo o estamos creando un isótopo diferente de ese elemento químico.
Preguntas frecuentes
1. ¿Por qué algunos átomos tienen isótopos?
Algunos átomos tienen isótopos porque tienen diferentes números de neutrones en el núcleo. Debido a que los neutrones no tienen carga, su número no afecta la carga del átomo. Sin embargo, el número de neutrones puede afectar las propiedades físicas y químicas del átomo.
2. ¿Cómo se representan los isótopos?
Los isótopos se representan escribiendo el nombre del elemento químico seguido del número total de protones y neutrones en el núcleo. Por ejemplo, el carbono-12 tiene seis protones y seis neutrones, mientras que el carbono-14 tiene seis protones y ocho neutrones.
3. ¿Qué es la masa atómica relativa?
La masa atómica relativa es la masa de un átomo en comparación con la masa de un átomo de carbono-12, que se define como 12 unidades de masa atómica (u). La masa atómica relativa se utiliza para comparar la masa de diferentes átomos y compuestos.
4. ¿Cómo se calcula la masa atómica relativa?
La masa atómica relativa se calcula dividiendo la masa atómica de un átomo por la masa atómica de un átomo de carbono-12 y multiplicando por 12. Por ejemplo, la masa atómica relativa del oxígeno es 15,999 u porque la masa atómica del oxígeno es aproximadamente 16 u y la masa atómica de un átomo de carbono-12 es 12 u.
5. ¿Por qué es importante la masa atómica relativa?
La masa atómica relativa es importante porque nos permite comparar la masa de diferentes átomos y compuestos. También nos permite calcular la cantidad de átomos presentes en una muestra de un compuesto.
Deja una respuesta