Descubre los 4 modelos atómicos: Dalton, Thomson, Rutherford y Bohr
La teoría atómica es uno de los pilares fundamentales de la física y la química moderna. Desde la antigua Grecia, los científicos han estado estudiando la estructura de la materia y cómo está compuesta. Sin embargo, fue a finales del siglo XIX y principios del siglo XX cuando se desarrollaron los primeros modelos atómicos que sentaron las bases para la comprensión actual de la estructura atómica.
En este artículo, vamos a explorar los cuatro modelos atómicos más importantes: Dalton, Thomson, Rutherford y Bohr. Cada uno de estos modelos representó un gran avance en nuestra comprensión de la estructura atómica, y aunque algunos de ellos no son completamente precisos, nos ayudaron a avanzar hacia una mejor comprensión de la materia y de cómo interactúa.
- 1. Modelo atómico de Dalton
- 2. Modelo atómico de Thomson
- 3. Modelo atómico de Rutherford
- 4. Modelo atómico de Bohr
- Conclusión
- Preguntas frecuentes
- 1. ¿Cuál es el modelo atómico más preciso?
- 2. ¿Por qué el modelo atómico de Thomson fue conocido como el "modelo del pudín de pasas"?
- 3. ¿Por qué el modelo atómico de Rutherford fue importante?
- 4. ¿Por qué el modelo atómico de Bohr fue importante?
- 5. ¿Cómo ha evolucionado la teoría atómica a lo largo del tiempo?
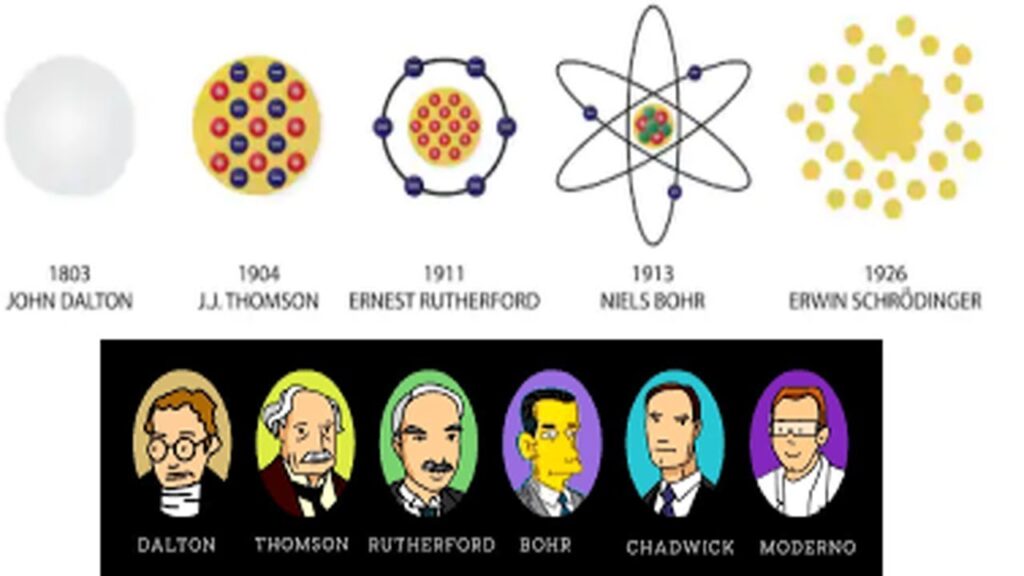
1. Modelo atómico de Dalton
El modelo atómico de Dalton fue propuesto por John Dalton en 1803. Dalton propuso que los átomos eran las unidades básicas de la materia y que cada elemento estaba compuesto por átomos idénticos. Además, Dalton creía que los átomos no podían dividirse en partes más pequeñas y que las reacciones químicas eran simplemente una reorganización de los átomos.
Este modelo atómico fue revolucionario porque proporcionó una forma de explicar la ley de conservación de la masa y la ley de proporciones definidas. Sin embargo, el modelo de Dalton no explicaba la existencia de los isótopos o de los iones, y no tenía en cuenta la estructura interna de los átomos.
2. Modelo atómico de Thomson
El modelo atómico de Thomson, propuesto en 1897 por J.J. Thomson, fue el primer modelo que tuvo en cuenta la estructura interna de los átomos. Thomson descubrió el electrón, una partícula subatómica con carga negativa, y propuso que los átomos eran esferas positivas con electrones incrustados en ellas.
Este modelo fue conocido como el "modelo del pudín de pasas", porque los electrones se parecían a las pasas en un pudín. Si bien el modelo de Thomson fue importante para la comprensión de la estructura atómica, no explicaba la distribución de la carga positiva en el átomo.
3. Modelo atómico de Rutherford
El modelo atómico de Rutherford, propuesto en 1911 por Ernest Rutherford, fue un gran avance en la comprensión de la distribución de la carga positiva en el átomo. Rutherford llevó a cabo el experimento de la lámina de oro, en el que disparó partículas alfa a través de una lámina de oro y midió su dispersión.
Rutherford descubrió que la mayoría de las partículas pasaban a través de la lámina de oro sin desviarse, pero algunas eran desviadas hacia ángulos inesperados. A partir de estos resultados, Rutherford propuso que los átomos tenían un núcleo pequeño y denso con carga positiva rodeado por electrones en órbita.
Este modelo atómico fue importante porque explicaba la distribución de la carga positiva en el átomo y la presencia de los electrones en órbita, pero no explicaba por qué los electrones no caían en el núcleo debido a la atracción electrostática.
4. Modelo atómico de Bohr
El modelo atómico de Bohr, propuesto en 1913 por Niels Bohr, fue una mejora del modelo de Rutherford. Bohr propuso que los electrones se encontraban en órbitas definidas alrededor del núcleo y que cada órbita correspondía a un nivel de energía específico.
Además, Bohr propuso que los electrones solo podían cambiar de órbita si absorbían o emitían un fotón de energía específica. Este modelo atómico fue importante porque explicaba la estabilidad de los átomos y la emisión y absorción de luz por parte de los átomos.
Conclusión
Los modelos atómicos de Dalton, Thomson, Rutherford y Bohr representaron grandes avances en nuestra comprensión de la estructura atómica. Cada modelo tuvo en cuenta diferentes aspectos de la estructura atómica y sentó las bases para el desarrollo de modelos más precisos en el futuro.
Aunque algunos de estos modelos no son completamente precisos, son importantes por las contribuciones que hicieron a nuestra comprensión de la naturaleza de la materia y de cómo interactúa.
Preguntas frecuentes
1. ¿Cuál es el modelo atómico más preciso?
El modelo atómico más preciso actualmente es el modelo cuántico, que tiene en cuenta la mecánica cuántica y la distribución de la carga positiva en el núcleo.
2. ¿Por qué el modelo atómico de Thomson fue conocido como el "modelo del pudín de pasas"?
El modelo atómico de Thomson fue conocido como el "modelo del pudín de pasas" porque los electrones se parecían a las pasas en un pudín.
3. ¿Por qué el modelo atómico de Rutherford fue importante?
El modelo atómico de Rutherford fue importante porque explicaba la distribución de la carga positiva en el átomo y la presencia de los electrones en órbita.
4. ¿Por qué el modelo atómico de Bohr fue importante?
El modelo atómico de Bohr fue importante porque explicaba la estabilidad de los átomos y la emisión y absorción de luz por parte de los átomos.
5. ¿Cómo ha evolucionado la teoría atómica a lo largo del tiempo?
La teoría atómica ha evolucionado a lo largo del tiempo a medida que se han descubierto nuevas partículas subatómicas y se ha desarrollado una mejor comprensión de la mecánica cuántica. Cada modelo atómico ha contribuido a nuestra comprensión actual de la estructura atómica y ha sentado las bases para el desarrollo de modelos más precisos en el futuro.
Deja una respuesta