Descubre el nombre de la suma de protones y neutrones
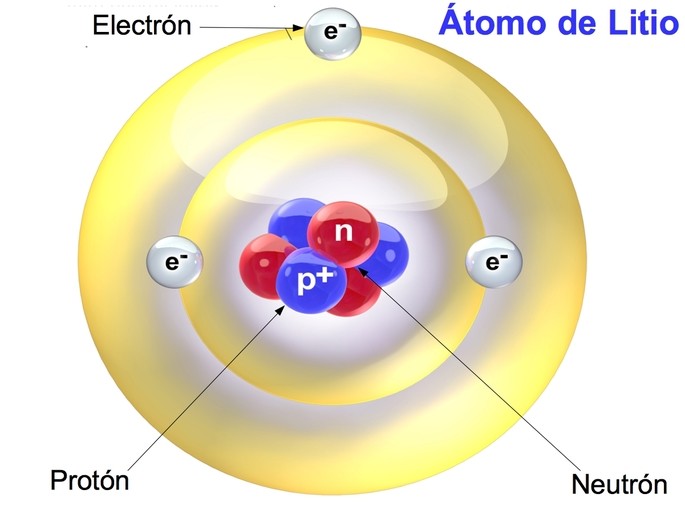
Cuando se habla de átomos, se suele referir a ellos como la unidad básica de la materia. Sin embargo, cada átomo está compuesto por varias partículas, siendo las más importantes los protones, los neutrones y los electrones. Los protones y los neutrones se encuentran en el núcleo del átomo, mientras que los electrones giran alrededor del mismo.
La suma de protones y neutrones en el núcleo de un átomo se conoce como masa atómica. Cada elemento químico tiene una masa atómica única, lo que significa que la cantidad de protones y neutrones en su núcleo es constante. Por ejemplo, el hidrógeno tiene una masa atómica de 1, ya que su núcleo solo contiene un protón y ningún neutrón. Por otro lado, el uranio tiene una masa atómica de 238, ya que su núcleo contiene 92 protones y 146 neutrones.
La masa atómica se mide en unidades de masa atómica (uma), que es una unidad de masa muy pequeña. Un átomo de carbono, por ejemplo, tiene una masa atómica de 12 uma, lo que significa que su masa es doce veces mayor que la masa de un átomo de hidrógeno.
Es importante tener en cuenta que la masa atómica no es lo mismo que el peso atómico. El peso atómico es la media ponderada de las masas atómicas de todos los isótopos de un elemento, teniendo en cuenta su abundancia natural. Por lo tanto, el peso atómico puede variar ligeramente dependiendo de la fuente del elemento.
La suma de protones y neutrones en el núcleo de un átomo se conoce como masa atómica. Es una propiedad única de cada elemento químico y se mide en unidades de masa atómica (uma). El peso atómico, por otro lado, es la media ponderada de las masas atómicas de todos los isótopos de un elemento.
¿Cómo se mide la masa atómica?
La masa atómica se mide utilizando una técnica llamada espectrometría de masas. En esencia, esta técnica consiste en vaporizar el elemento químico a estudiar y luego ionizar los átomos resultantes. Los iones se aceleran a través de un campo eléctrico y se separan según su relación masa-carga en un espectrómetro de masas. De esta manera, se puede determinar la masa atómica de cada isótopo y su abundancia natural.
¿Por qué la masa atómica es importante?
La masa atómica es una propiedad fundamental de cada elemento químico y es importante en muchos aspectos de la química y la física. Por ejemplo, la masa atómica se utiliza para calcular la composición de los compuestos químicos y la estequiometría de las reacciones químicas. También se utiliza para determinar la energía de enlace entre los átomos y la estabilidad de los núcleos atómicos.
¿Cómo se relaciona la masa atómica con la energía nuclear?
La masa atómica es una propiedad importante en la física nuclear y la energía nuclear. La energía nuclear se libera cuando los núcleos atómicos se fusionan o se dividen. La masa atómica de los núcleos resultantes es ligeramente diferente de la masa atómica de los núcleos iniciales, debido a la liberación o absorción de energía. Esta diferencia de masa se conoce como defecto de masa y es la base de la famosa ecuación de Einstein, E = mc².
¿Qué es un isótopo?
Un isótopo es un átomo de un elemento químico que tiene el mismo número de protones en su núcleo, pero un número diferente de neutrones. Debido a esto, los isótopos tienen la misma carga nuclear pero una masa atómica diferente. Por ejemplo, el carbono-12 y el carbono-14 son isótopos del carbono, ya que ambos tienen seis protones, pero el carbono-12 tiene seis neutrones y el carbono-14 tiene ocho.
¿Qué es la radiactividad?
La radiactividad es un fenómeno en el que ciertos núcleos atómicos son inestables y emiten partículas o radiación para alcanzar una configuración más estable. La radiación puede ser en forma de partículas alfa, beta o gamma, y puede ser peligrosa para la salud si se expone en grandes cantidades. La radiactividad se utiliza en medicina, energía nuclear y datación de materiales antiguos.
Deja una respuesta