Ejercicios resueltos de moles, moléculas y átomos para 3º de ESO
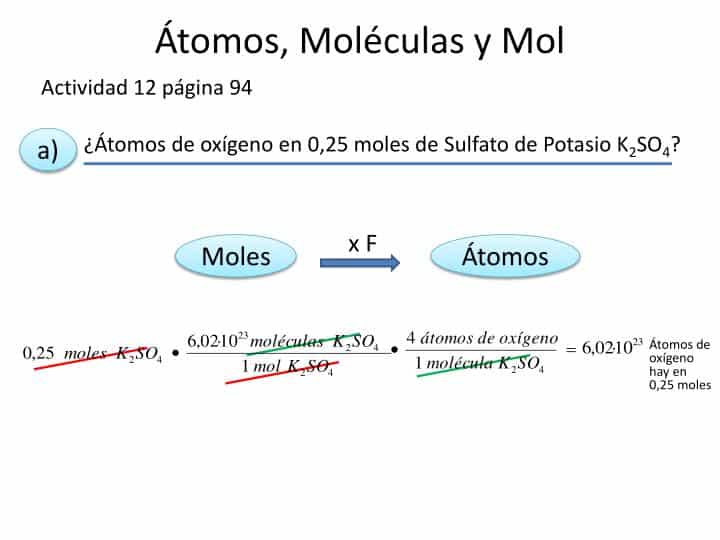
En el estudio de la química, los conceptos de moles, moléculas y átomos son fundamentales para entender cómo se comportan las sustancias en las reacciones químicas. En este artículo, presentamos una serie de ejercicios resueltos para que los estudiantes de 3º de ESO puedan practicar y afianzar estos conceptos.
- 1. ¿Qué es un mol?
- 2. ¿Cómo se calcula el número de moles?
- 3. ¿Qué es una molécula?
- 4. ¿Cómo se calcula el número de moléculas?
- 5. ¿Qué es un átomo?
- 6. ¿Cómo se calcula la masa atómica?
- 7. Ejercicio resuelto: cálculo del número de moles
- 8. Ejercicio resuelto: cálculo del número de moléculas
- 9. Ejercicio resuelto: cálculo de la masa
- 10. Ejercicio resuelto: cálculo del número de átomos
- 11. Ejercicio resuelto: cálculo del número de átomos
- 12. Ejercicio resuelto: cálculo del número de moles
- 13. Ejercicio resuelto: cálculo del número de moléculas
1. ¿Qué es un mol?
Un mol es una unidad de medida que se utiliza en química para expresar la cantidad de sustancia. Un mol equivale a la cantidad de átomos presentes en 12 gramos de carbono-12. Es decir, un mol de cualquier sustancia contiene el mismo número de partículas que un mol de carbono-12, que es aproximadamente 6,02 x 10^23 partículas.
2. ¿Cómo se calcula el número de moles?
Para calcular el número de moles de una sustancia, se divide la masa de la sustancia entre su masa molar. La masa molar es la masa de un mol de la sustancia y se expresa en gramos por mol. Por ejemplo, si tenemos 10 gramos de agua (H2O), podemos calcular el número de moles de la siguiente manera:
- Masa molar del agua: 18 gramos por mol (2 átomos de hidrógeno con masa atómica de 1 y 1 átomo de oxígeno con masa atómica de 16).
- Número de moles de agua: 10 gramos / 18 gramos por mol = 0,556 moles de agua.
3. ¿Qué es una molécula?
Una molécula es un conjunto de átomos unidos entre sí mediante enlaces químicos. Las moléculas pueden ser compuestas, formadas por átomos de diferentes elementos, o simples, formadas por átomos del mismo elemento. Por ejemplo, el agua (H2O) es una molécula compuesta formada por dos átomos de hidrógeno y uno de oxígeno.
4. ¿Cómo se calcula el número de moléculas?
Para calcular el número de moléculas de una sustancia, se multiplica el número de moles por el número de Avogadro, que es aproximadamente 6,02 x 10^23. Por ejemplo, si tenemos 0,556 moles de agua, podemos calcular el número de moléculas de la siguiente manera:
- Número de moléculas de agua: 0,556 moles x 6,02 x 10^23 moléculas por mol = 3,34 x 10^23 moléculas de agua.
5. ¿Qué es un átomo?
Un átomo es la unidad básica de la materia, formada por un núcleo central compuesto por protones y neutrones, rodeado por electrones. Los protones tienen carga positiva, los electrones tienen carga negativa y los neutrones no tienen carga. La cantidad de protones determina el número atómico del elemento y la cantidad de neutrones y protones determina el peso atómico.
6. ¿Cómo se calcula la masa atómica?
La masa atómica se calcula sumando la masa de los protones y neutrones presentes en el núcleo del átomo. Se expresa en unidades de masa atómica (u) y se utiliza como referencia la masa del átomo de carbono-12, que se define como 12 u. Por ejemplo, la masa atómica del carbono-14 es de 14 u, ya que tiene 6 protones y 8 neutrones en su núcleo.
7. Ejercicio resuelto: cálculo del número de moles
Calcular el número de moles de 36 gramos de cloruro de sodio (NaCl).
- Masa molar del NaCl: 23 + 35,5 = 58,5 gramos por mol.
- Número de moles de NaCl: 36 gramos / 58,5 gramos por mol = 0,615 moles de NaCl.
8. Ejercicio resuelto: cálculo del número de moléculas
Calcular el número de moléculas en 0,5 moles de dióxido de carbono (CO2).
- Número de moléculas de CO2: 0,5 moles x 6,02 x 10^23 moléculas por mol = 3,01 x 10^23 moléculas de CO2.
9. Ejercicio resuelto: cálculo de la masa
Calcular la masa de 2 moles de ácido sulfúrico (H2SO4).
- Masa molar del H2SO4: 2 + 32 + 64 = 98 gramos por mol.
- Masa de 2 moles de H2SO4: 2 moles x 98 gramos por mol = 196 gramos de H2SO4.
10. Ejercicio resuelto: cálculo del número de átomos
Calcular el número de átomos de oxígeno presentes en 1,5 moles de dióxido de carbono (CO2).
- Número de átomos de oxígeno en CO2: 2 átomos de oxígeno por mol de CO2.
- Número de átomos de oxígeno en 1,5 moles de CO2: 1,5 moles x 2 átomos de oxígeno por mol = 3 átomos de oxígeno.
11. Ejercicio resuelto: cálculo del número de átomos
Calcular el número de átomos de hidrógeno presentes en 5 gramos de agua (H2O).
- Masa molar del H2O: 2 + 16 = 18 gramos por mol.
- Número de moles de H2O: 5 gramos / 18 gramos por mol = 0,278 moles de H2O.
- Número de átomos de hidrógeno en H2O: 2 átomos de hidrógeno por mol de H2O.
- Número de átomos de hidrógeno en 0,278 moles de H2O: 0,278 moles x 2 átomos de hidrógeno por mol = 0,556 átomos de hidrógeno.
12. Ejercicio resuelto: cálculo del número de moles
Calcular el número de moles de 25 gramos de dióxido de carbono (CO2).
- Masa molar del CO2: 12 + 32 = 44 gramos por mol.
- Número de moles de CO2: 25 gramos / 44 gramos por mol = 0,568 moles de CO2.
13. Ejercicio resuelto: cálculo del número de moléculas
Calcular el número de moléculas en 2 moles de cloruro de hidrógeno (HCl).
- Número de moléculas de HCl: 2 moles x 6,02 x 10^23 moléculas por mol =
Deja una respuesta