Descubre cómo calcular el peso atómico de un elemento
El peso atómico de un elemento es una propiedad importante que se utiliza en química para determinar la masa de un átomo en una escala relativa. Es una medida que indica la cantidad de masa de un átomo en comparación con la masa de un átomo de carbono-12.
El peso atómico se obtiene a partir de la masa atómica de un elemento, que es la suma de las masas de sus protones, neutrones y electrones. En este artículo, te mostraremos cómo calcular el peso atómico de un elemento de manera sencilla y clara.
¿Qué es el peso atómico?
Antes de profundizar en cómo calcular el peso atómico, es importante entender lo que significa este término. El peso atómico se refiere a la masa promedio de los átomos de un elemento en una muestra. Es un número que representa la relación entre la masa de un átomo de un elemento y la masa de un átomo de referencia.
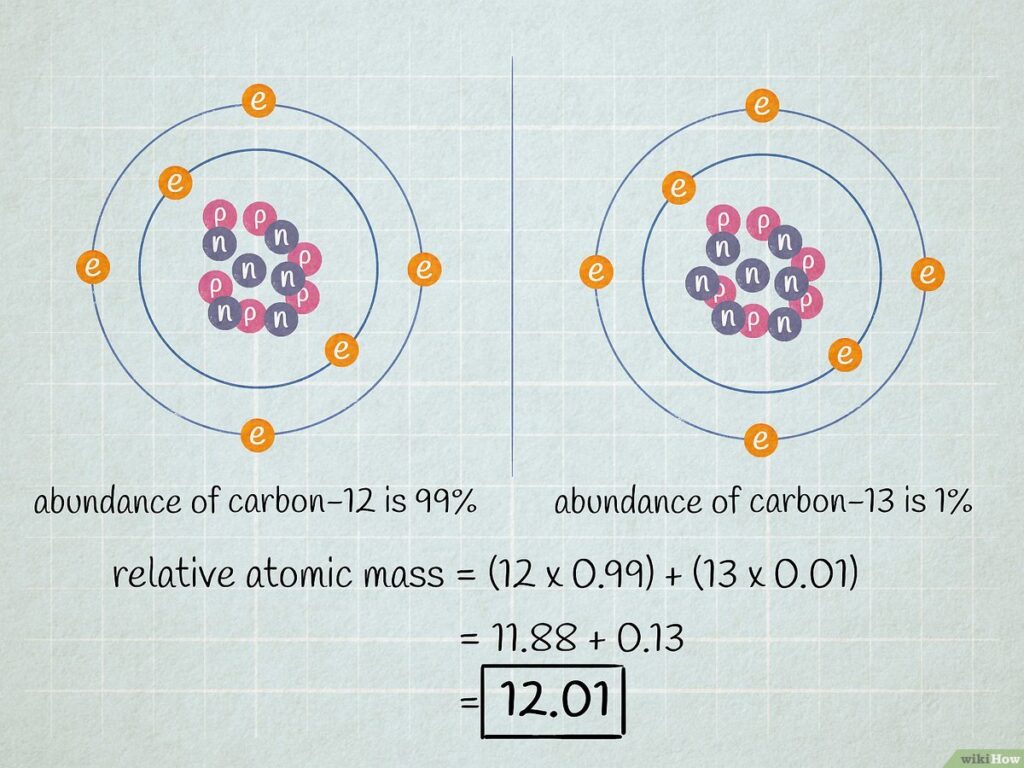
El átomo de referencia utilizado para calcular el peso atómico es el carbono-12, que se define como 12 unidades de masa atómica (uma). Por lo tanto, el peso atómico de un elemento es el número de masas atómicas de ese elemento que se necesitan para igualar la masa de un átomo de carbono-12.
Cómo calcular el peso atómico
El peso atómico de un elemento se puede calcular utilizando la siguiente fórmula:
Peso atómico = (fracción isotópica 1 x masa isotópica 1) + (fracción isotópica 2 x masa isotópica 2) + (fracción isotópica 3 x masa isotópica 3) + ...
Donde "fracción isotópica" se refiere a la proporción de cada isótopo de un elemento en una muestra y "masa isotópica" se refiere a la masa de cada isótopo.
Para obtener la fracción isotópica de un elemento, se debe dividir la cantidad de cada isótopo en la muestra por el número total de átomos de ese elemento en la muestra. La suma de todas las fracciones isotópicas de un elemento debe ser igual a 1.
Para entender mejor cómo se aplica esta fórmula, veamos un ejemplo:
Calculemos el peso atómico del cloro (Cl), que tiene dos isótopos estables: cloro-35 y cloro-37. La fracción isotópica del cloro-35 es del 75,77% y la del cloro-37 es del 24,23%. Las masas isotópicas del cloro-35 y cloro-37 son 34,97 uma y 36,97 uma, respectivamente.
Peso atómico del cloro = (0,7577 x 34,97) + (0,2423 x 36,97) = 35,45 uma
Por lo tanto, el peso atómico del cloro es de 35,45 unidades de masa atómica.
Factores que afectan al peso atómico
Es importante tener en cuenta que el peso atómico de un elemento puede variar en diferentes muestras debido a la presencia de isótopos diferentes o a la contaminación de la muestra. Además, el peso atómico de un elemento puede variar en diferentes lugares del mundo debido a la variación en la proporción de isótopos en la naturaleza.
Tabla de pesos atómicos de los elementos
A continuación, se presenta una tabla con los pesos atómicos de algunos elementos comunes:
| Elemento | Peso atómico |
| --- | --- |
| Hidrógeno (H) | 1,008 |
| Carbono (C) | 12,011 |
| Nitrógeno (N) | 14,007 |
| Oxígeno (O) | 15,999 |
| Calcio (Ca) | 40,078 |
| Hierro (Fe) | 55,845 |
| Cobre (Cu) | 63,546 |
| Plata (Ag) | 107,868 |
| Oro (Au) | 196,967 |
Conclusión
El peso atómico es una propiedad importante que se utiliza en química para determinar la masa de un átomo en una escala relativa. Se puede calcular utilizando la fórmula que se presentó en este artículo, que tiene en cuenta la fracción isotópica y la masa isotópica de un elemento en una muestra. Es importante recordar que el peso atómico puede variar en diferentes muestras y lugares del mundo debido a la presencia de isótopos diferentes o a la contaminación de la muestra.
Preguntas frecuentes
¿Cómo se determina la fracción isotópica de un elemento?
La fracción isotópica de un elemento se determina dividiendo la cantidad de cada isótopo en una muestra por el número total de átomos de ese elemento en la muestra.
¿Qué es un isótopo?
Un isótopo es un átomo de un elemento que tiene el mismo número de protones en el núcleo, pero un número diferente de neutrones.
¿Por qué se utiliza el carbono-12 como átomo de referencia?
El carbono-12 se utiliza como átomo de referencia porque es el isótopo más común del carbono y tiene una masa estable y conocida de 12 unidades de masa atómica.
¿Por qué el peso atómico puede variar en diferentes muestras?
El peso atómico puede variar en diferentes muestras debido a la presencia de isótopos diferentes o a la contaminación de la muestra.
¿Por qué el peso atómico puede variar en diferentes lugares del mundo?
El peso atómico puede variar en diferentes lugares del mundo debido a la variación en la proporción de isótopos en la naturaleza.
Deja una respuesta