El modelo atómico de Bohr: solución a la estructura atómica
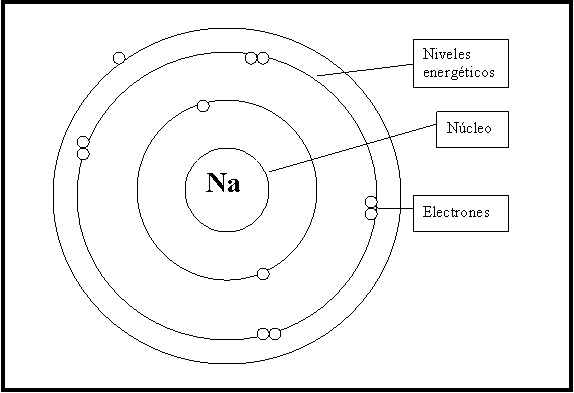
El modelo atómico de Bohr es uno de los logros más importantes de la historia de la ciencia. En su momento, este modelo permitió entender la estructura atómica de una manera que nunca antes había sido posible. Este modelo, propuesto por el físico danés Niels Bohr en 1913, fue una solución revolucionaria a uno de los mayores problemas de la física de la época: la estructura de los átomos.
En este artículo, exploraremos en detalle el modelo atómico de Bohr, desde su desarrollo hasta las implicaciones que tuvo en la física moderna. También responderemos a algunas preguntas frecuentes sobre este tema.
- 1. El problema de la estructura atómica
- 2. La teoría de Bohr
- 3. Implicaciones para la física moderna
- 4. Preguntas frecuentes sobre el modelo atómico de Bohr
- ¿Cómo se explica la existencia de niveles de energía en el átomo?
- ¿Cómo se explica la emisión y absorción de luz por los átomos?
- ¿Cómo se relaciona el modelo de Bohr con la mecánica cuántica?
- ¿Cuál es la importancia del modelo de Bohr en la tecnología moderna?
- ¿Cuál es la relevancia del modelo de Bohr en la investigación actual?
- 5. Conclusión
1. El problema de la estructura atómica
A principios del siglo XX, la física estaba experimentando una gran revolución. Los científicos estaban descubriendo que la materia estaba compuesta por átomos, pero no sabían cómo estos átomos estaban estructurados. Se sabía que los átomos estaban compuestos por electrones, protones y neutrones, pero no se comprendía cómo estos componentes interactuaban entre sí.
En este contexto, el modelo atómico de Bohr fue una solución revolucionaria. Bohr propuso que los electrones se movían en órbitas alrededor del núcleo del átomo, y que estas órbitas estaban determinadas por la energía de los electrones.
2. La teoría de Bohr
El modelo de Bohr se basó en la teoría cuántica emergente en la época. En lugar de considerar que los electrones se movían en órbitas continuas alrededor del núcleo, Bohr propuso que los electrones solo podían ocupar ciertas órbitas discretas. Estas órbitas se correspondían con diferentes niveles de energía.
Bohr también propuso que los electrones solo podían saltar entre órbitas si absorbían o emitían una cantidad específica de energía. Esto se conoce como el principio de cuantización de la energía. El modelo de Bohr postuló que los átomos tenían un número limitado de niveles de energía y que los electrones se movían entre estos niveles mediante saltos cuánticos.
3. Implicaciones para la física moderna
El modelo atómico de Bohr tuvo implicaciones importantes para la física moderna. Este modelo permitió explicar la estructura de los átomos y cómo interactuaban con la radiación electromagnética. También permitió explicar la emisión y absorción de luz por los átomos y fue fundamental para el desarrollo de la mecánica cuántica.
El modelo de Bohr también tuvo implicaciones en la tecnología moderna. Por ejemplo, permitió el desarrollo de los láseres, que se basan en la emisión estimulada de radiación electromagnética y en los principios de la cuantización de la energía.
4. Preguntas frecuentes sobre el modelo atómico de Bohr
¿Cómo se explica la existencia de niveles de energía en el átomo?
Los niveles de energía en el átomo se deben a la cuantización de la energía. Según el modelo de Bohr, los electrones solo pueden ocupar ciertas órbitas discretas alrededor del núcleo del átomo. Estas órbitas se corresponden con diferentes niveles de energía, y los electrones solo pueden saltar entre estos niveles mediante saltos cuánticos.
¿Cómo se explica la emisión y absorción de luz por los átomos?
La emisión y absorción de luz por los átomos se debe a los saltos cuánticos de los electrones entre los diferentes niveles de energía. Cuando un electrón salta de un nivel de energía más alto a uno más bajo, emite un fotón de luz. Por el contrario, cuando un electrón salta de un nivel de energía más bajo a uno más alto, absorbe un fotón de luz.
¿Cómo se relaciona el modelo de Bohr con la mecánica cuántica?
El modelo de Bohr fue uno de los primeros modelos cuánticos de la estructura atómica. Este modelo permitió explicar la cuantización de la energía en los átomos y sentó las bases para el desarrollo de la mecánica cuántica.
¿Cuál es la importancia del modelo de Bohr en la tecnología moderna?
El modelo de Bohr fue fundamental para el desarrollo de la tecnología moderna en muchas áreas, como la electrónica, la química y la física de los materiales. Por ejemplo, permitió el desarrollo de los láseres, que se basan en los principios de la emisión estimulada de radiación electromagnética y en la cuantización de la energía.
¿Cuál es la relevancia del modelo de Bohr en la investigación actual?
Aunque el modelo de Bohr ha sido superado por modelos más complejos y precisos, sigue siendo una herramienta útil en la investigación actual. Por ejemplo, se utiliza en la interpretación de los espectros de emisión y absorción de los átomos y moléculas, así como en la comprensión de la estructura de los materiales.
5. Conclusión
El modelo atómico de Bohr fue una solución revolucionaria al problema de la estructura atómica. Este modelo permitió explicar la cuantización de la energía en los átomos y sentó las bases para el desarrollo de la mecánica cuántica. Además, tuvo implicaciones importantes en la tecnología moderna, como el desarrollo de los láseres. Aunque ha sido superado por modelos más precisos, sigue siendo una herramienta útil en la investigación actual.
Deja una respuesta