Descubre los componentes del modelo atómico de Bohr
El modelo atómico de Bohr es uno de los modelos más importantes en la historia de la física. Fue desarrollado por el físico danés Niels Bohr en 1913 y ha sido clave para entender la estructura de los átomos y su comportamiento. En este artículo, descubriremos los componentes de este modelo y cómo ayudan a entender la física atómica.
- ¿Qué es el modelo atómico de Bohr?
- Componentes del modelo atómico de Bohr
- Aplicaciones del modelo atómico de Bohr
- Preguntas frecuentes
- 1. ¿Por qué los electrones sólo pueden existir en ciertos niveles de energía?
- 2. ¿Cómo se emiten los fotones cuando los electrones saltan entre niveles de energía?
- 3. ¿Por qué los átomos son estables?
- 4. ¿Cómo ha impactado el modelo de Bohr en la física y la química?
- 5. ¿Por qué el modelo de Bohr fue un avance tan importante en la física?
¿Qué es el modelo atómico de Bohr?
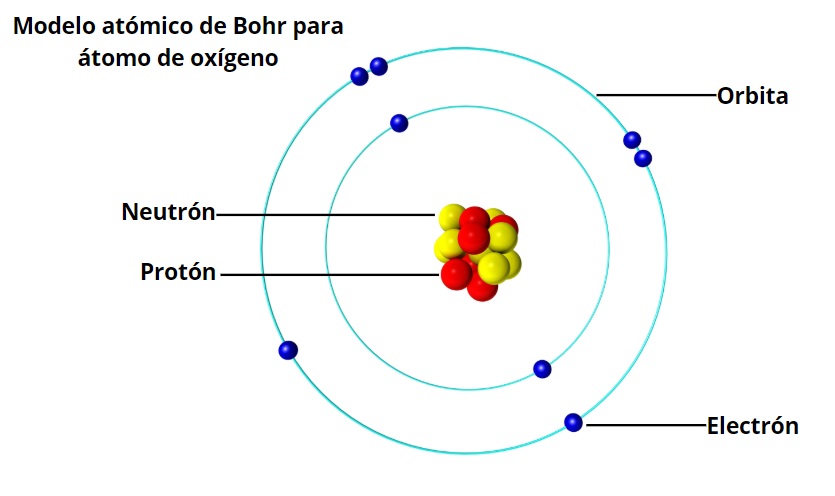
El modelo atómico de Bohr describe al átomo como un núcleo central positivo rodeado por electrones que orbitan en órbitas circulares discretas. Según este modelo, los electrones sólo pueden existir en ciertos niveles de energía, y al absorber o emitir energía, saltan entre estos niveles.
Componentes del modelo atómico de Bohr
El modelo atómico de Bohr se basa en varios componentes clave:
1. Núcleo
El núcleo es la parte central del átomo que contiene protones y neutrones. Los protones tienen carga positiva y los neutrones no tienen carga. Juntos, los protones y los neutrones forman la mayor parte de la masa del átomo.
2. Electrones
Los electrones son partículas subatómicas que orbitan alrededor del núcleo. Tienen carga negativa y son mucho más pequeños que los protones y neutrones. Según el modelo de Bohr, los electrones sólo pueden existir en ciertos niveles de energía y saltan entre ellos al absorber o emitir energía.
3. Órbitas
Las órbitas son las trayectorias circulares que siguen los electrones alrededor del núcleo. Según el modelo de Bohr, estas órbitas son discretas y sólo ciertos niveles de energía permiten a los electrones existir en ellas.
4. Niveles de energía
Los niveles de energía son los diferentes niveles en los que pueden existir los electrones. Estos niveles están numerados y se representan por la letra "n". El nivel más cercano al núcleo es el nivel n=1 y los niveles se vuelven más energéticos a medida que aumenta el valor de n.
5. Fotones
Los fotones son partículas de luz que se emiten o absorben cuando los electrones saltan entre niveles de energía. Estos fotones tienen una energía específica que corresponde al salto que hizo el electrón.
Aplicaciones del modelo atómico de Bohr
El modelo atómico de Bohr ha sido fundamental para explicar muchos fenómenos físicos, incluyendo la emisión de luz por los átomos, la producción de espectros de emisión y absorción, y la estabilidad de los átomos. Además, ha sentado las bases para la comprensión de la estructura de los átomos y las moléculas, lo que ha llevado a avances en la química y la física.
Preguntas frecuentes
1. ¿Por qué los electrones sólo pueden existir en ciertos niveles de energía?
Según el modelo de Bohr, los electrones sólo pueden existir en ciertos niveles de energía porque estas órbitas son estables y no permiten que los electrones caigan hacia el núcleo. Si un electrón tuviera demasiada energía y estuviera en una órbita más lejana, estaría menos estable y sería más probable que cayera hacia el núcleo.
2. ¿Cómo se emiten los fotones cuando los electrones saltan entre niveles de energía?
Cuando un electrón salta de un nivel de energía más alto a uno más bajo, emite un fotón con una energía específica que corresponde al salto que hizo. Del mismo modo, cuando un electrón absorbe un fotón, salta a un nivel de energía más alto.
3. ¿Por qué los átomos son estables?
Los átomos son estables porque los electrones están en órbitas discretas y estables alrededor del núcleo. Si los electrones estuvieran en órbitas más aleatorias, sería más probable que chocaran con el núcleo y se desintegraran.
4. ¿Cómo ha impactado el modelo de Bohr en la física y la química?
El modelo de Bohr ha sido fundamental para el desarrollo de la física y la química modernas. Ha sentado las bases para la comprensión de la estructura de los átomos y las moléculas, lo que ha llevado a avances en la química y la física.
5. ¿Por qué el modelo de Bohr fue un avance tan importante en la física?
El modelo de Bohr fue un avance tan importante en la física porque permitió a los científicos entender la estructura de los átomos y su comportamiento. Antes del modelo de Bohr, los científicos no entendían cómo los electrones podían estar en una órbita estable alrededor del núcleo sin caer hacia él. El modelo de Bohr proporcionó una explicación para este fenómeno y sentó las bases para la comprensión de la física atómica.
Deja una respuesta