Uniendo átomos: el proceso de formación de compuestos
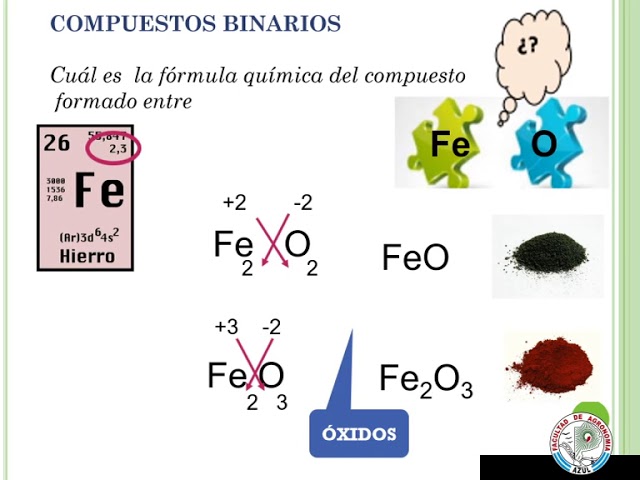
¿Alguna vez te has preguntado cómo se forman los compuestos químicos? ¿Cómo es que los átomos se unen para crear moléculas con propiedades únicas y distintas a los elementos por sí solos? En este artículo, exploraremos el fascinante proceso de unir átomos para formar compuestos.
¿Qué son los compuestos químicos?
Antes de entrar en detalle sobre cómo se forman los compuestos, es importante entender qué son. Un compuesto químico es una sustancia pura formada por dos o más elementos químicos diferentes unidos en proporciones definidas. Estos elementos se unen mediante enlaces químicos, creando una nueva estructura con propiedades físicas y químicas únicas.
¿Cómo se unen los átomos para formar un compuesto?
Los átomos se unen para formar un compuesto a través de enlaces químicos. Un enlace químico es la fuerza que mantiene a dos o más átomos juntos en una molécula. Los átomos pueden unirse mediante tres tipos de enlaces químicos: enlaces iónicos, enlaces covalentes y enlaces metálicos.
Enlaces iónicos
Los enlaces iónicos se forman cuando un átomo pierde electrones y otro átomo los gana. El átomo que pierde electrones se convierte en un ion positivo, llamado catión, mientras que el átomo que gana electrones se convierte en un ion negativo, llamado anión. Los iones con cargas opuestas se atraen y se unen para formar un compuesto iónico.
Enlaces covalentes
Los enlaces covalentes se forman cuando dos átomos comparten electrones. Los átomos comparten electrones para formar un par de electrones compartidos, también conocido como un enlace covalente. Los enlaces covalentes son más comunes en moléculas formadas por átomos no metálicos.
Enlaces metálicos
Los enlaces metálicos se forman entre átomos de metales. Los átomos de metal comparten sus electrones de valencia, creando una "nube" de electrones que rodea a los átomos en un cristal metálico.
¿Cómo se determina el tipo de enlace químico?
El tipo de enlace químico que se forma depende de la electronegatividad de los átomos involucrados. La electronegatividad es la capacidad de un átomo para atraer electrones hacia sí mismo. Cuando dos átomos tienen una gran diferencia de electronegatividad, se formará un enlace iónico. Si la diferencia de electronegatividad es pequeña, se formará un enlace covalente. En el caso de los metales, que tienen baja electronegatividad, se formará un enlace metálico.
¿Cómo se nombran los compuestos químicos?
Los compuestos químicos se nombran siguiendo una convención establecida por la IUPAC (Unión Internacional de Química Pura y Aplicada). Los nombres de los compuestos se basan en los nombres de los elementos que los componen y en las proporciones en las que se unen. Por ejemplo, el compuesto formado por un átomo de hidrógeno y uno de oxígeno se llama agua (H2O).
¿Por qué es importante la formación de compuestos?
La formación de compuestos es importante porque permite la creación de nuevas sustancias con propiedades únicas. Muchos de los materiales que utilizamos en nuestra vida diaria son compuestos químicos, como medicamentos, plásticos, detergentes, productos alimenticios y materiales de construcción.
Conclusión
La formación de compuestos químicos es un proceso fascinante que permite la creación de sustancias con propiedades únicas. Los átomos se unen mediante enlaces químicos para crear moléculas que pueden ser sólidas, líquidas o gaseosas. La capacidad de los átomos para unirse y formar compuestos es esencial para la vida en la Tierra y para el desarrollo de tecnologías y materiales que mejoran nuestra calidad de vida.
Preguntas frecuentes
1. ¿Cómo se determina el tipo de enlace químico?
El tipo de enlace químico se determina por la electronegatividad de los átomos involucrados. Si hay una gran diferencia de electronegatividad, se formará un enlace iónico. Si la diferencia de electronegatividad es pequeña, se formará un enlace covalente. En el caso de los metales, se formará un enlace metálico.
2. ¿Cuál es la importancia de los compuestos químicos?
La formación de compuestos químicos es importante porque permite la creación de nuevas sustancias con propiedades únicas. Muchos de los materiales que utilizamos en nuestra vida diaria son compuestos químicos, como medicamentos, plásticos, detergentes, productos alimenticios y materiales de construcción.
3. ¿Cómo se nombran los compuestos químicos?
Los compuestos químicos se nombran siguiendo una convención establecida por la IUPAC (Unión Internacional de Química Pura y Aplicada). Los nombres de los compuestos se basan en los nombres de los elementos que los componen y en las proporciones en las que se unen.
4. ¿Qué es un enlace covalente?
Un enlace covalente se forma cuando dos átomos comparten electrones. Los átomos comparten electrones para formar un par de electrones compartidos, también conocido como un enlace covalente.
5. ¿Cómo se forman los enlaces iónicos?
Los enlaces iónicos se forman cuando un átomo pierde electrones y otro átomo los gana. El átomo que pierde electrones se convierte en un ion positivo, llamado catión, mientras que el átomo que gana electrones se convierte en un ion negativo, llamado anión. Los iones con cargas opuestas se atraen y se unen para formar un compuesto iónico.
Deja una respuesta