Descubre el radio atómico y afinidad electrónica de los elementos
Cuando se trata de entender las propiedades de los elementos químicos, hay varias características importantes que debemos considerar. Dos de las más importantes son el radio atómico y la afinidad electrónica. El radio atómico se refiere al tamaño de un átomo en particular, mientras que la afinidad electrónica se refiere a la cantidad de energía que se libera cuando un átomo gana un electrón. En este artículo, exploraremos más a fondo estas dos características y cómo afectan la química de los elementos.
¿Qué es el radio atómico?
El radio atómico se refiere al tamaño de un átomo en particular. La razón por la que es importante es que el tamaño de un átomo puede influir en cómo interactúa con otros átomos. Por ejemplo, si dos átomos tienen radios atómicos similares, es más probable que se unan y formen un compuesto estable. Si los radios atómicos son muy diferentes, una unión estable es menos probable.
¿Cómo se mide el radio atómico?
El radio atómico se mide en nanómetros (nm) o en picómetros (pm). Un nanómetro es una mil millonésima parte de un metro, mientras que un picómetro es una diez mil millonésima parte de un metro. Para medir el radio atómico, los científicos utilizan una variedad de técnicas, como la difracción de rayos X.
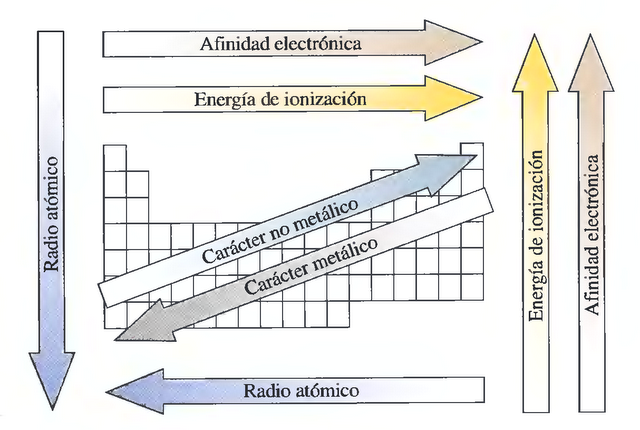
¿Cómo varía el radio atómico en la tabla periódica?
El radio atómico tiende a disminuir a medida que se mueve de izquierda a derecha en la tabla periódica. Esto se debe a que a medida que se mueve a la derecha, hay más protones en el núcleo del átomo, lo que atrae más fuertemente a los electrones. Sin embargo, el radio atómico tiende a aumentar a medida que se mueve hacia abajo en un grupo de la tabla periódica. Esto se debe a que hay más capas de electrones alrededor del núcleo, lo que hace que el átomo sea más grande.
¿Qué es la afinidad electrónica?
La afinidad electrónica se refiere a la cantidad de energía que se libera cuando un átomo gana un electrón. En otras palabras, es una medida de cuánto un átomo quiere ganar un electrón adicional. La afinidad electrónica es importante porque puede influir en cómo un átomo reacciona con otros átomos y en su capacidad para formar compuestos.
¿Cómo se mide la afinidad electrónica?
La afinidad electrónica se mide en electronvoltios (eV). Un electrónvoltio es la cantidad de energía necesaria para mover un electrón a través de un potencial eléctrico de un voltio. Para medir la afinidad electrónica de un átomo, los científicos pueden utilizar una variedad de técnicas, como la espectroscopía de fotoelectrones.
¿Cómo varía la afinidad electrónica en la tabla periódica?
La afinidad electrónica tiende a aumentar a medida que se mueve de izquierda a derecha en la tabla periódica. Esto se debe a que los átomos a la derecha de la tabla periódica tienen una electronegatividad más fuerte, lo que significa que atraen más fuertemente a los electrones. Sin embargo, la afinidad electrónica tiende a disminuir a medida que se mueve hacia abajo en un grupo de la tabla periódica. Esto se debe a que los átomos más grandes tienen capas de electrones más lejanas del núcleo, lo que significa que los electrones adicionales son menos atraídos.
¿Cómo afectan el radio atómico y la afinidad electrónica a la química de los elementos?
El radio atómico y la afinidad electrónica son dos características importantes que pueden influir en la química de los elementos. Por ejemplo, si dos átomos tienen radios atómicos similares, es más probable que se unan y formen un compuesto estable. Si los radios atómicos son muy diferentes, una unión estable es menos probable. De manera similar, si un átomo tiene una alta afinidad electrónica, es más probable que atraiga electrones de otros átomos y forme compuestos estables.
¿Cómo afecta el radio atómico a la reactividad química?
El radio atómico puede influir en la reactividad química de un átomo. En general, los átomos con radios atómicos más pequeños tienen una mayor electronegatividad y son más reactivos. Esto se debe a que los electrones están más cerca del núcleo, lo que significa que los átomos pueden interactuar más fácilmente con otros átomos.
¿Cómo afecta la afinidad electrónica a la reactividad química?
La afinidad electrónica también puede influir en la reactividad química de un átomo. En general, los átomos con una alta afinidad electrónica son más reactivos porque atraen electrones de otros átomos con mayor fuerza. Esto puede hacer que los átomos se unan más fácilmente y formen compuestos más estables.
Conclusión
El radio atómico y la afinidad electrónica son dos características importantes que pueden influir en la química de los elementos. El radio atómico se refiere al tamaño de un átomo en particular, mientras que la afinidad electrónica se refiere a la cantidad de energía que se libera cuando un átomo gana un electrón. Estas características pueden influir en cómo los átomos interactúan entre sí y en su capacidad para formar compuestos estables.
Preguntas frecuentes
¿Cómo se relaciona el radio atómico con la carga nuclear efectiva?
La carga nuclear efectiva se refiere a la atracción neta que los electrones sienten del núcleo del átomo. A medida que la carga nuclear efectiva aumenta, los electrones son atraídos más fuertemente hacia el núcleo, lo que puede hacer que el radio atómico disminuya.
¿Cómo se relaciona la afinidad electrónica con la electronegatividad?
La afinidad electrónica y la electronegatividad están estrechamente relacionadas. La electronegatividad se refiere a la capacidad de un átomo para atraer electrones hacia sí mismo, mientras que la afinidad electrónica se refiere a la cantidad de energía que se libera cuando un átomo gana un electrón. Los átomos con una alta electronegatividad también tienden a tener una alta afinidad electrónica.
¿Cómo afecta la estructura electrónica de un átomo al radio atómico?
La estructura electrónica de un átomo puede influir en su radio atómico. Por ejemplo, si un átomo tiene electrones en capas más externas, su radio atómico será mayor. Esto se debe a que los electrones externos interactúan menos con el núcleo, lo que significa que el átomo es más grande.
Deja una respuesta