Descubre los postulados de Bohr para el átomo de hidrógeno
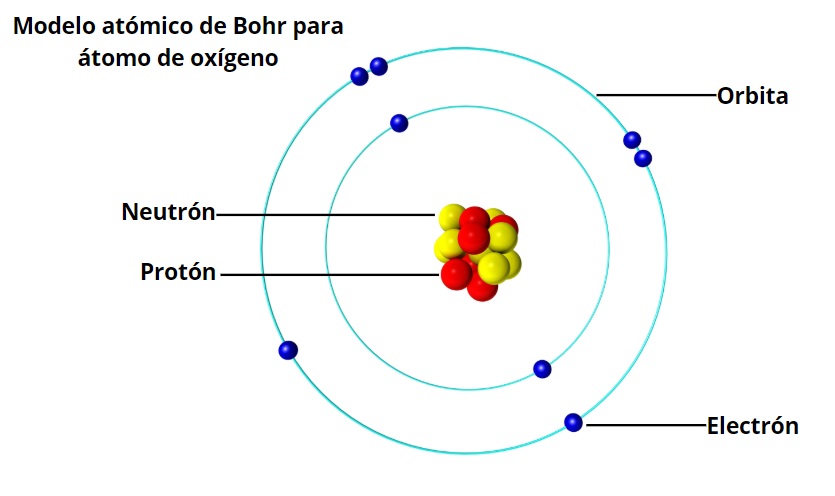
El átomo de hidrógeno es uno de los elementos más simples y cruciales en la química y la física moderna. El modelo atómico de Bohr, propuesto por el físico danés Niels Bohr en 1913, revolucionó la comprensión de la estructura atómica y ayudó a resolver muchos de los misterios de la física cuántica. En este artículo, descubriremos los postulados de Bohr para el átomo de hidrógeno.
- Postulado 1: El electrón viaja en órbitas circulares alrededor del núcleo
- Postulado 2: Solo ciertos niveles de energía son permitidos
- Postulado 3: La energía de un electrón es cuantizada
- Postulado 4: La radiación electromagnética se emite cuando un electrón salta de una órbita a otra
- Postulado 5: El átomo de hidrógeno emite luz en espectros discretos
- Conclusión
- Preguntas frecuentes
- 1. ¿Por qué el modelo atómico de Bohr es importante?
- 2. ¿Cómo se relacionan los postulados de Bohr con la emisión de espectros discretos de luz del átomo de hidrógeno?
- 3. ¿Cuántos niveles de energía están permitidos en el átomo de hidrógeno?
- 4. ¿Por qué solo se permiten ciertos niveles de energía en el átomo de hidrógeno?
- 5. ¿Cómo se relaciona el modelo atómico de Bohr con la química?
Postulado 1: El electrón viaja en órbitas circulares alrededor del núcleo
Bohr propuso que el electrón en el átomo de hidrógeno no puede estar en cualquier lugar alrededor del núcleo, sino que se mueve en órbitas circulares. Además, las órbitas tienen un radio y una energía específicos. A medida que el electrón se mueve de una órbita a otra, emite o absorbe energía en forma de fotones.
Postulado 2: Solo ciertos niveles de energía son permitidos
Bohr también afirmó que solo se permiten ciertos niveles de energía para el electrón en el átomo de hidrógeno. Estos niveles de energía están determinados por la cantidad de energía que el electrón puede absorber o emitir al moverse de una órbita a otra. Cada nivel de energía tiene un número cuántico principal (n) que puede tomar valores enteros positivos.
Postulado 3: La energía de un electrón es cuantizada
De acuerdo con Bohr, la energía total de un electrón en el átomo de hidrógeno es la suma de su energía cinética y potencial. La energía potencial es inversamente proporcional al radio de la órbita, mientras que la energía cinética es directamente proporcional a la velocidad del electrón. La energía total del electrón solo puede tomar valores discretos y cuantizados, que están determinados por el nivel de energía en el que se encuentra.
Postulado 4: La radiación electromagnética se emite cuando un electrón salta de una órbita a otra
Cuando un electrón en el átomo de hidrógeno salta de una órbita de mayor energía a una de menor energía, emite radiación electromagnética en forma de un fotón. La energía del fotón es igual a la diferencia entre las energías de las dos órbitas. De manera similar, cuando un electrón absorbe un fotón, salta a una órbita de mayor energía.
Postulado 5: El átomo de hidrógeno emite luz en espectros discretos
El modelo atómico de Bohr también explica por qué el átomo de hidrógeno emite luz en espectros discretos. Cada espectro corresponde a la emisión de fotones de diferentes energías que se producen cuando los electrones saltan de una órbita a otra. Debido a que solo se permiten ciertos niveles de energía en el átomo de hidrógeno, solo se emiten fotones de energías específicas.
Conclusión
Los postulados de Bohr para el átomo de hidrógeno revolucionaron la comprensión de la estructura atómica y la física cuántica en general. Estos postulados ayudaron a explicar muchos de los misterios observados en el comportamiento del átomo de hidrógeno y sentaron las bases para la comprensión de la estructura atómica de elementos más complejos.
Preguntas frecuentes
1. ¿Por qué el modelo atómico de Bohr es importante?
El modelo atómico de Bohr es importante porque ayudó a resolver muchos de los misterios de la física cuántica y sentó las bases para la comprensión de la estructura atómica de elementos más complejos.
2. ¿Cómo se relacionan los postulados de Bohr con la emisión de espectros discretos de luz del átomo de hidrógeno?
Los postulados de Bohr explican por qué el átomo de hidrógeno emite luz en espectros discretos. Cada espectro corresponde a la emisión de fotones de diferentes energías que se producen cuando los electrones saltan de una órbita a otra.
3. ¿Cuántos niveles de energía están permitidos en el átomo de hidrógeno?
En el átomo de hidrógeno, se permiten un número infinito de niveles de energía, pero solo ciertos niveles de energía están permitidos. Estos niveles de energía están determinados por la cantidad de energía que el electrón puede absorber o emitir al moverse de una órbita a otra.
4. ¿Por qué solo se permiten ciertos niveles de energía en el átomo de hidrógeno?
Solo se permiten ciertos niveles de energía en el átomo de hidrógeno porque la energía total del electrón solo puede tomar valores discretos y cuantizados, que están determinados por el nivel de energía en el que se encuentra.
5. ¿Cómo se relaciona el modelo atómico de Bohr con la química?
El modelo atómico de Bohr es importante en química porque ayuda a explicar cómo los electrones interactúan en los átomos y las moléculas. La comprensión de la estructura atómica y molecular es fundamental para la química y la comprensión de las propiedades y reacciones químicas.
Deja una respuesta