De Demócrito a la actualidad: la evolución del modelo atómico
Los seres humanos siempre hemos estado fascinados por el mundo que nos rodea, y una de las preguntas más importantes que nos hemos hecho es: ¿de qué están hechas las cosas? Desde la antigua Grecia hasta la actualidad, nuestra comprensión de la estructura de la materia ha evolucionado enormemente. En este artículo, vamos a explorar la evolución del modelo atómico desde la perspectiva de la historia de la ciencia.
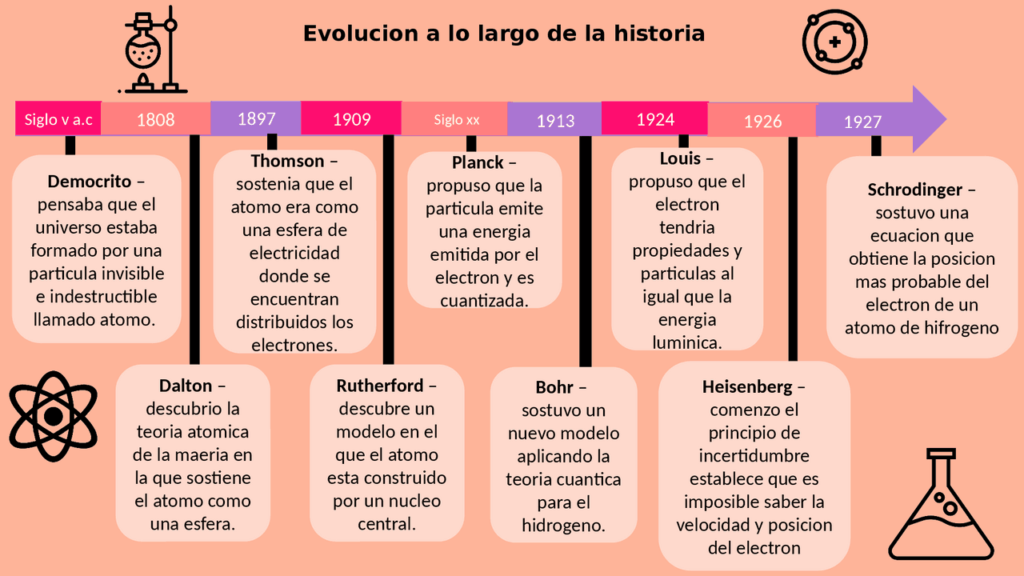
1. Demócrito y la idea de los átomos
La idea de que todo está hecho de pequeñas partículas indivisibles, llamadas átomos, fue propuesta por primera vez por Demócrito, un filósofo griego que vivió en el siglo V a.C. Demócrito creía que los átomos eran eternos e invisibles a simple vista, y que todo lo que existe en el universo está compuesto por ellos.
2. El modelo atómico de Dalton
A principios del siglo XIX, el químico británico John Dalton propuso una teoría más formal sobre la estructura atómica. Según Dalton, los átomos son esferas sólidas e indivisibles que se combinan para formar moléculas. Además, Dalton propuso que los átomos de un elemento eran idénticos en peso y tamaño, mientras que los átomos de diferentes elementos tenían diferentes pesos y tamaños.
3. El modelo atómico de Thomson
A finales del siglo XIX, el físico británico J.J. Thomson descubrió el electrón, una partícula subatómica con carga negativa. Thomson propuso un nuevo modelo atómico en el que los átomos eran esferas positivas con electrones incrustados en ellas, como pasas en un pudín. Este modelo se conoce como el modelo del "pudín de pasas".
4. El modelo atómico de Rutherford
En 1911, el físico neozelandés Ernest Rutherford realizó un experimento que demostró que los átomos tenían un núcleo central denso y cargado positivamente rodeado por electrones en órbita. Rutherford propuso un nuevo modelo atómico en el que los electrones orbitaban alrededor del núcleo como planetas en un sistema solar.
5. El modelo atómico de Bohr
En 1913, el físico danés Niels Bohr desarrolló un modelo atómico más refinado en el que los electrones orbitaban el núcleo en órbitas específicas y estables. Según el modelo de Bohr, los electrones solo podían existir en ciertos niveles de energía, y cuando saltaban de un nivel a otro, emitían o absorbían energía en forma de luz.
6. El modelo atómico actual
Hoy en día, el modelo atómico actual se basa en la teoría cuántica, que describe la naturaleza de la materia y la energía a nivel subatómico. Según esta teoría, los electrones no se mueven en órbitas definidas, sino que existen en nubes de probabilidad alrededor del núcleo. Además, se ha descubierto que los protones y los neutrones, las partículas que forman el núcleo, están compuestos por partículas aún más pequeñas llamadas quarks.
Conclusión
La evolución del modelo atómico es un ejemplo fascinante de cómo la ciencia avanza y cambia con el tiempo. A medida que se han desarrollado nuevas tecnologías y herramientas de investigación, nuestra comprensión de la estructura de la materia ha evolucionado desde la idea de Demócrito de los átomos indivisibles hasta el modelo cuántico actual. Aunque aún hay mucho que aprender, el futuro promete descubrimientos aún más emocionantes.
Preguntas frecuentes
1. ¿Cómo se descubrieron los electrones?
Los electrones fueron descubiertos por J.J. Thomson en 1897 mediante un experimento con tubos de rayos catódicos.
2. ¿Por qué se llama al modelo de Thomson el "pudín de pasas"?
El modelo de Thomson se llama así porque propone que los electrones están incrustados en una esfera de carga positiva, como pasas en un pudín.
3. ¿Cómo se descubrió el núcleo atómico?
El núcleo atómico fue descubierto por Ernest Rutherford en 1911 mediante un experimento en el que bombardeó átomos con partículas alfa.
4. ¿Qué son los quarks?
Los quarks son partículas subatómicas que componen los protones y los neutrones en el núcleo atómico.
5. ¿Qué es la teoría cuántica?
La teoría cuántica es una teoría que describe la naturaleza de la materia y la energía a nivel subatómico, y se basa en la idea de que las partículas subatómicas tienen propiedades tanto de partículas como de ondas.
Deja una respuesta