Calcula la masa atómica fácilmente: Guía paso a paso
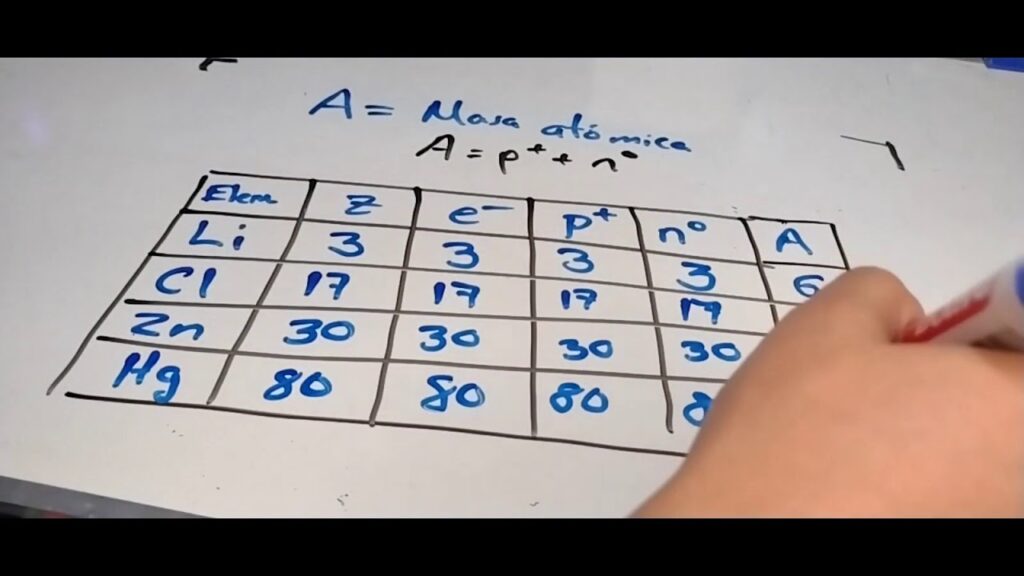
La masa atómica es un concepto fundamental en la química, ya que nos permite conocer la masa de un átomo en una escala relativa. Es importante conocer cómo se calcula la masa atómica para poder entender muchos de los procesos químicos que ocurren en nuestro entorno. En este artículo, te explicaremos cómo calcular la masa atómica fácilmente paso a paso.
¿Qué es la masa atómica?
La masa atómica es la masa de un átomo expresada en una unidad de masa atómica (uma). La una se define como la doceava parte de la masa de un átomo de carbono-12. Por lo tanto, la masa atómica de un átomo se expresa como un número que indica cuántas veces su masa es mayor que la masa de un átomo de carbono-12.
¿Cómo se calcula la masa atómica?
Para calcular la masa atómica de un elemento, se deben sumar las masas de los protones y neutrones presentes en su núcleo. Los electrones no se tienen en cuenta ya que su masa es muy pequeña en comparación con la de los protones y neutrones.
Paso 1: Identificar el número de protones y neutrones
El número de protones de un átomo se conoce como su número atómico (Z) y se encuentra en la tabla periódica. El número de neutrones se puede obtener restando el número atómico de la masa atómica.
Ejemplo:
El número atómico del carbono es 6, lo que significa que tiene 6 protones en su núcleo. Si la masa atómica del carbono es de 12.01 uma, entonces el número de neutrones es de 6.01 (12.01 - 6).
Paso 2: Calcular la masa de los protones y neutrones
La masa de los protones y neutrones se expresa en una unidad de masa atómica (uma). Un átomo de carbono-12 tiene 6 protones y 6 neutrones, lo que significa que la masa de un protón o un neutrón es de aproximadamente 1 uma.
Ejemplo:
La masa de los protones en un átomo de carbono es de 6 uma (6 protones x 1 uma/protón = 6 uma). La masa de los neutrones en un átomo de carbono es de 6 uma (6 neutrones x 1 uma/neutrón = 6 uma).
Paso 3: Sumar las masas de los protones y neutrones
Para calcular la masa atómica de un elemento, se deben sumar las masas de los protones y neutrones presentes en su núcleo.
Ejemplo:
La masa atómica del carbono es de 12.01 uma. Esto significa que la masa de los protones y neutrones en un átomo de carbono es de 12.01 uma (6 uma de protones + 6.01 uma de neutrones = 12.01 uma).
¿Cómo se calcula la masa atómica promedio?
La masa atómica promedio de un elemento se calcula teniendo en cuenta la abundancia de sus isótopos en la naturaleza. Un isótopo es una variedad de un elemento que tiene el mismo número atómico pero una masa atómica diferente debido a un número diferente de neutrones.
Paso 1: Identificar los isótopos y su abundancia
La abundancia de los isótopos se expresa como un porcentaje relativo a la suma total de las abundancias de todos los isótopos del elemento.
Ejemplo:
El carbono tiene dos isótopos principales: el carbono-12 y el carbono-13. El carbono-12 es el isótopo más común y su abundancia es del 98,9%. El carbono-13 tiene una abundancia del 1,1%.
Paso 2: Calcular la masa atómica promedio
Para calcular la masa atómica promedio de un elemento, se multiplica la masa de cada isótopo por su abundancia relativa y se suman los resultados.
Ejemplo:
La masa atómica promedio del carbono se puede calcular como:
(masa del isótopo 1 x abundancia del isótopo 1) + (masa del isótopo 2 x abundancia del isótopo 2)
(12 uma x 0,989) + (13,003 uma x 0,011) = 12,01 uma
Por lo tanto, la masa atómica promedio del carbono es de 12,01 uma.
Conclusión
La masa atómica es un concepto fundamental en la química y se utiliza para entender muchos de los procesos químicos que ocurren en nuestro entorno. Calcular la masa atómica de un elemento es fácil siguiendo los pasos que te hemos explicado en este artículo. Si necesitas calcular la masa atómica promedio, también es un proceso sencillo que se puede realizar con la información disponible en la tabla periódica.
Preguntas frecuentes
1. ¿Por qué no se tienen en cuenta los electrones en el cálculo de la masa atómica?
Los electrones tienen una masa muy pequeña en comparación con la de los protones y neutrones, por lo que no se tienen en cuenta en el cálculo de la masa atómica.
2. ¿Qué es una unidad de masa atómica?
Una unidad de masa atómica (uma) es la doceava parte de la masa de un átomo de carbono-12.
3. ¿Por qué se calcula la masa atómica promedio?
La masa atómica promedio se calcula para tener en cuenta la abundancia de los isótopos del elemento en la naturaleza.
4. ¿Cómo se lee la masa atómica en la tabla periódica?
La masa atómica se encuentra debajo del símbolo del elemento en la tabla periódica.
5. ¿Por qué la masa atómica del carbono no es un número entero?
La masa atómica del carbono no es un número entero porque se calcula teniendo en cuenta la abundancia de sus isótopos en la naturaleza.
Deja una respuesta