Descubre la estructura del átomo y sus secretos
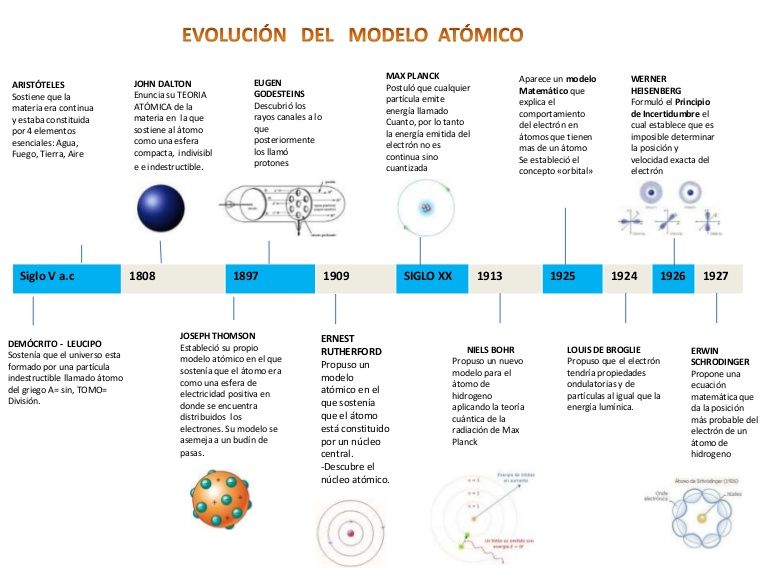
El átomo es una de las piezas claves de la química y la física moderna. Desde su descubrimiento, ha sido objeto de estudio y análisis constante por parte de los científicos, y aún hoy en día se siguen descubriendo nuevos secretos y propiedades que nos ayudan a entender mejor el mundo en el que vivimos.
En este artículo, vamos a profundizar en la estructura del átomo, sus componentes y características, así como en algunos de los secretos que se esconden dentro de su núcleo.
¿Qué es un átomo?
Un átomo es la unidad básica de la materia. Está compuesto por un núcleo central, formado por protones y neutrones, y una corteza externa, formada por electrones. Los protones tienen carga positiva, los electrones tienen carga negativa y los neutrones no tienen carga.
La cantidad de protones en el núcleo de un átomo determina su número atómico y, por lo tanto, su elemento químico. Los elementos químicos se representan mediante símbolos, como el H para el hidrógeno, el O para el oxígeno o el Fe para el hierro.
La estructura del átomo
El núcleo del átomo es el centro de la estructura atómica. Está formado por protones y neutrones, que se mantienen unidos por la fuerza nuclear fuerte. Esta fuerza es una de las cuatro fuerzas fundamentales de la naturaleza, junto con la fuerza electromagnética, la fuerza gravitatoria y la fuerza nuclear débil.
Los protones tienen carga positiva y los neutrones no tienen carga. La carga eléctrica total del núcleo es positiva, debido a la presencia de protones. Los electrones, por su parte, tienen carga negativa y se encuentran en la corteza externa del átomo.
La corteza externa del átomo es la parte más grande de la estructura atómica. Está formada por electrones en constante movimiento alrededor del núcleo. Los electrones se distribuyen en diferentes niveles de energía, llamados capas electrónicas o niveles de energía.
Los niveles de energía
Los electrones se distribuyen en los niveles de energía siguiendo una serie de reglas:
- Cada nivel de energía puede contener un número máximo de electrones.
- Los electrones llenan primero los niveles de energía más cercanos al núcleo.
- Los electrones llenan los niveles de energía en orden creciente de energía.
- Los electrones pueden saltar de un nivel de energía a otro si reciben o liberan energía.
Los electrones y la química
Los electrones son los responsables de las propiedades químicas de los átomos. La forma en que los electrones se distribuyen en la corteza externa del átomo determina cómo interactúa con otros átomos y moléculas.
Cuando dos átomos se unen para formar una molécula, los electrones de ambos átomos interactúan entre sí. Esta interacción se llama enlace químico y es la base de la química.
Los secretos del núcleo del átomo
A pesar de que la estructura del átomo está bien establecida, aún quedan muchos secretos por descubrir en su núcleo.
Uno de los mayores misterios es la existencia de los neutrinos. Los neutrinos son partículas subatómicas que tienen muy poca masa y no tienen carga eléctrica. Fueron descubiertos en 1956, pero aún no se comprende completamente su papel en el universo.
Otro misterio es la existencia de la materia oscura. La materia oscura es una forma de materia que no emite ni refleja luz ni ninguna otra forma de radiación electromagnética, por lo que no puede ser detectada directamente. Se cree que la materia oscura representa aproximadamente el 27% de la masa del universo, pero aún no se sabe qué es exactamente.
Conclusión
La estructura del átomo es una de las piezas clave de la física y la química moderna. Su estudio nos ha permitido entender mejor el mundo en el que vivimos y ha llevado a importantes descubrimientos en muchos campos de la ciencia.
Aunque la estructura del átomo está bien establecida, aún quedan muchos secretos por descubrir en su núcleo. La investigación continua en este campo será fundamental para entender mejor el universo que nos rodea.
Preguntas frecuentes
¿Por qué se llama átomo?
La palabra "átomo" proviene del griego "atomos", que significa "indivisible". Los antiguos griegos creían que la materia estaba formada por partículas indivisibles e indestructibles llamadas átomos.
¿Qué es un isótopo?
Un isótopo es una variante de un elemento químico que tiene el mismo número de protones en su núcleo, pero un número diferente de neutrones. Debido a esta diferencia en el número de neutrones, los isótopos tienen propiedades físicas y químicas ligeramente diferentes.
¿Qué es la radiación ionizante?
La radiación ionizante es una forma de radiación que tiene suficiente energía para ionizar átomos y moléculas. Esto significa que puede arrancar electrones de los átomos, lo que puede tener efectos dañinos en los seres vivos.
¿Qué es un neutrón?
Un neutrón es una partícula subatómica que se encuentra en el núcleo de un átomo. Tiene una masa similar a la de un protón, pero no tiene carga eléctrica.
¿Cómo se descubrieron los electrones?
Los electrones fueron descubiertos en 1897 por el físico británico J.J. Thomson. Utilizó un tubo de vacío llamado tubo de rayos catódicos para estudiar la descarga eléctrica en gases a baja presión. Descubrió que los rayos catódicos estaban compuestos por partículas con carga negativa, que llamó electrones.
Deja una respuesta