Cálculo de masa atómica: ¡Aprende a sacarla fácilmente!
La masa atómica es una medida de la masa de un átomo, que se expresa en unidades de masa atómica. A menudo, se confunde con el peso atómico, pero hay una diferencia importante entre estos dos términos. La masa atómica se refiere a la masa de un átomo en particular, mientras que el peso atómico es un promedio ponderado de las masas atómicas de todos los isótopos de un elemento.
El cálculo de la masa atómica es una tarea importante en la química y la física porque puede ayudar a determinar las propiedades de un elemento. En este artículo, aprenderás cómo calcular la masa atómica de un elemento de manera fácil y rápida.
¿Cómo se calcula la masa atómica?
La masa atómica se calcula sumando el número de protones y neutrones en el núcleo de un átomo. Los electrones no se incluyen en el cálculo debido a que su masa es muy pequeña en comparación con la masa de los protones y neutrones.
Paso 1: Determinar el número de protones y neutrones
Primero, debes determinar el número de protones y neutrones en el núcleo de un átomo. El número de protones se conoce como número atómico y se representa por Z en la tabla periódica. El número de neutrones se puede determinar restando el número atómico del número de masa.
Por ejemplo, el hierro tiene un número atómico de 26 y un número de masa de 56. Por lo tanto, tiene 26 protones y 30 neutrones (56 - 26 = 30).
Paso 2: Determinar la contribución relativa de cada isótopo
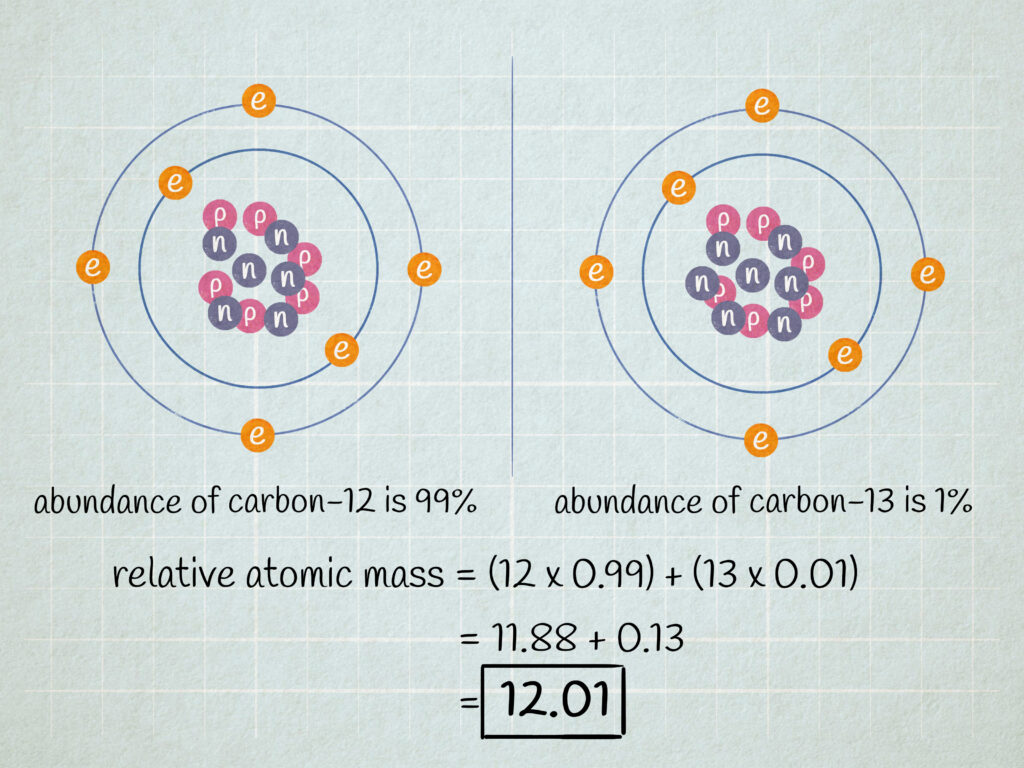
Los isótopos son átomos del mismo elemento que tienen diferentes números de neutrones. La mayoría de los elementos tienen varios isótopos, y cada uno de ellos contribuye a la masa atómica del elemento en diferentes proporciones.
Para calcular la masa atómica, debes determinar la contribución relativa de cada isótopo. Esto se hace multiplicando la masa de cada isótopo por su abundancia relativa y sumando los resultados.
Por ejemplo, el cloro tiene dos isótopos: cloro-35 y cloro-37. La abundancia relativa del cloro-35 es del 75%, mientras que la del cloro-37 es del 25%. Por lo tanto, la contribución relativa del cloro-35 a la masa atómica es del 75%, y la del cloro-37 es del 25%.
Paso 3: Calcular la masa atómica
Por último, para calcular la masa atómica de un elemento, debes sumar las contribuciones relativas de cada isótopo.
Por ejemplo, la masa atómica del hierro se calcula multiplicando la masa del isótopo de hierro-54 por su abundancia relativa (5,8%), la masa del isótopo de hierro-56 por su abundancia relativa (91,7%), y la masa del isótopo de hierro-57 por su abundancia relativa (2,5%), y sumando los resultados.
(54 x 0,058) + (56 x 0,917) + (57 x 0,025) = 55,85 u
Por lo tanto, la masa atómica del hierro es de 55,85 u.
Conclusión
Calcular la masa atómica es una tarea importante en la química y la física. Aunque puede parecer complicado al principio, siguiendo los pasos descritos anteriormente, puedes calcular la masa atómica de cualquier elemento de manera fácil y rápida.
Preguntas frecuentes
1. ¿Qué es la masa atómica relativa?
La masa atómica relativa, también conocida como peso atómico relativo, es una medida de la masa de un átomo en relación con la masa de un átomo de carbono-12, que se define como 12 unidades de masa atómica.
2. ¿Qué es un isótopo?
Un isótopo es un átomo del mismo elemento que tiene diferentes números de neutrones. Esto significa que los isótopos tienen el mismo número de protones pero diferentes números de masa.
3. ¿Por qué los electrones no se incluyen en el cálculo de la masa atómica?
Los electrones tienen una masa muy pequeña en comparación con la masa de los protones y neutrones en el núcleo de un átomo. Por lo tanto, su masa se considera insignificante en el cálculo de la masa atómica.
4. ¿Cómo se determina la abundancia relativa de un isótopo?
La abundancia relativa de un isótopo se determina midiendo la cantidad de ese isótopo en una muestra y comparándola con la cantidad total de ese elemento en la muestra.
5. ¿Por qué es importante calcular la masa atómica?
Calcular la masa atómica es importante porque puede ayudar a determinar las propiedades de un elemento, como su punto de fusión, punto de ebullición y densidad. También es importante en la química analítica, donde se utilizan técnicas como la espectrometría de masas para identificar y cuantificar los elementos en una muestra.
Deja una respuesta