Cálculo de masa atómica de isotopos: guía práctica
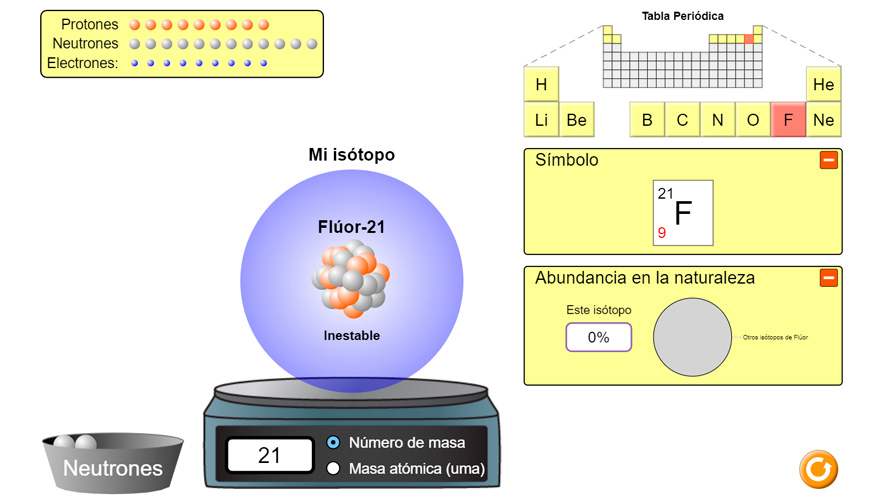
La masa atómica de un elemento es la suma de las masas de sus protones y neutrones en el núcleo. Sin embargo, algunos elementos tienen diferentes isótopos con diferentes cantidades de neutrones, lo que afecta su masa atómica. En este artículo, aprenderás cómo calcular la masa atómica de isotopos y su importancia en la química.
¿Qué son los isotopos?
Los isotopos son átomos del mismo elemento con diferentes números de neutrones. Por ejemplo, el carbono tiene tres isotopos: carbono-12, carbono-13 y carbono-14. Todos tienen el mismo número de protones (6), pero diferentes números de neutrones (6, 7 y 8, respectivamente).
¿Por qué es importante conocer la masa atómica de isotopos?
La masa atómica de isotopos es importante en la química porque muchos elementos tienen más de un isótopo y la masa atómica promedio es utilizada en cálculos de estequiometría. La masa atómica se utiliza para determinar la cantidad de un elemento presente en una muestra, así como para calcular la masa molecular de un compuesto.
Cálculo de masa atómica de isotopos
El cálculo de la masa atómica de isotopos se realiza utilizando la siguiente fórmula:
Masa atómica = (% de isótopo 1 x masa de isótopo 1) + (% de isótopo 2 x masa de isótopo 2) + ...
Por ejemplo, el cloro tiene dos isótopos, cloro-35 y cloro-37, con porcentajes naturales de 75.77% y 24.23%, respectivamente. Para calcular la masa atómica promedio del cloro, se utiliza la siguiente fórmula:
Masa atómica del cloro = (75.77% x 35.0 amu) + (24.23% x 37.0 amu) = 35.5 amu
Ejemplo práctico
Veamos otro ejemplo práctico de cómo calcular la masa atómica de isotopos. El magnesio tiene tres isótopos: magnesio-24, magnesio-25 y magnesio-26, con porcentajes naturales de 78.99%, 10.00% y 11.01%, respectivamente. Para calcular la masa atómica promedio del magnesio, se utiliza la siguiente fórmula:
Masa atómica del magnesio = (78.99% x 24.0 amu) + (10.00% x 25.0 amu) + (11.01% x 26.0 amu) = 24.31 amu
Tabla de masas atómicas de algunos elementos
A continuación, se muestra una tabla con las masas atómicas de algunos elementos comunes:
| Elemento | Masa atómica |
|---|---|
| Hidrógeno | 1.008 amu |
| Carbono | 12.011 amu |
| Nitrógeno | 14.007 amu |
| Oxígeno | 15.999 amu |
| Calcio | 40.078 amu |
| Hierro | 55.845 amu |
Conclusión
La masa atómica de isotopos es importante para la química porque permite calcular la cantidad de un elemento presente en una muestra y la masa molecular de un compuesto. El cálculo de la masa atómica se realiza utilizando la fórmula que toma en cuenta los porcentajes naturales de los isótopos y sus masas. Es importante tener en cuenta las masas atómicas de los elementos en los cálculos químicos para obtener resultados precisos.
Preguntas frecuentes
1. ¿Qué es un isótopo?
Un isótopo es un átomo del mismo elemento con diferentes números de neutrones.
2. ¿Por qué es importante conocer la masa atómica de isotopos?
La masa atómica de isotopos es importante en la química porque muchos elementos tienen más de un isótopo y la masa atómica promedio es utilizada en cálculos de estequiometría.
3. ¿Cómo se calcula la masa atómica de isotopos?
La masa atómica de isotopos se calcula utilizando la fórmula que toma en cuenta los porcentajes naturales de los isótopos y sus masas.
4. ¿Para qué se utiliza la masa atómica de un elemento?
La masa atómica de un elemento se utiliza para determinar la cantidad de un elemento presente en una muestra, así como para calcular la masa molecular de un compuesto.
5. ¿Dónde se encuentran los porcentajes naturales de los isótopos?
Los porcentajes naturales de los isótopos se encuentran en la tabla periódica de los elementos.
Deja una respuesta