Atomo vs. Molecula: ¿Quién es más grande?
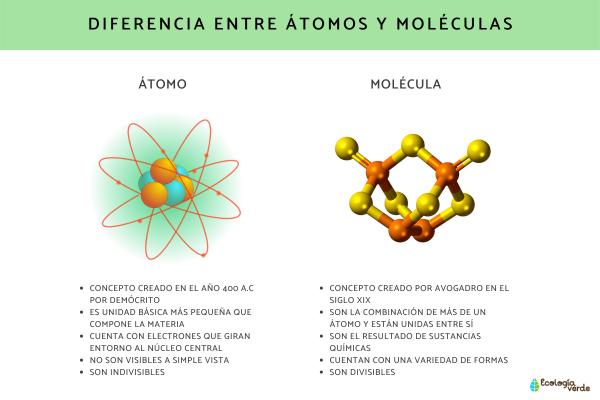
Si alguna vez has tomado una clase de química, es probable que hayas escuchado los términos "átomo" y "molécula". Los átomos son las unidades más pequeñas de la materia, mientras que las moléculas están formadas por dos o más átomos unidos entre sí. Pero, ¿cuál de estos es más grande? En este artículo, exploraremos esta pregunta y descubriremos la respuesta.
¿Qué es un átomo?
Un átomo es la unidad más pequeña de la materia que todavía mantiene las propiedades químicas de un elemento. Está compuesto por un núcleo central que contiene protones y neutrones, rodeado por electrones que orbitan alrededor del núcleo. Los átomos varían en tamaño dependiendo del elemento, pero el diámetro de un átomo típico es de alrededor de 0.1 a 0.5 nanómetros.
¿Qué es una molécula?
Las moléculas son dos o más átomos que se unen mediante enlaces químicos para formar una estructura más grande. Pueden ser compuestos de elementos diferentes o del mismo elemento. Las moléculas pueden variar en tamaño desde pequeñas, como la molécula de agua (H2O), hasta grandes, como la molécula de proteína.
Comparando tamaños
Entonces, ¿cuál es más grande, un átomo o una molécula? La respuesta no es tan simple como parece. Los átomos individuales son más pequeños que las moléculas, pero en términos de volumen, las moléculas pueden ser más grandes. Esto se debe a que las moléculas tienen una estructura tridimensional, mientras que los átomos son esencialmente esferas bidimensionales.
En términos de masa, las moléculas también pueden ser más grandes que los átomos. Las moléculas están formadas por varios átomos, lo que significa que tienen más masa que un átomo individual. Sin embargo, la masa no siempre se correlaciona directamente con el tamaño. Por ejemplo, una molécula de dióxido de carbono puede tener más masa que una molécula de agua, pero la molécula de agua es más grande en términos de volumen.
Ejemplos comparativos
Para entender mejor la diferencia de tamaño entre átomos y moléculas, se pueden comparar algunos ejemplos de cada uno. Por ejemplo, el diámetro de un átomo de hidrógeno es de aproximadamente 0.1 nanómetros, mientras que el diámetro de una molécula de agua es de aproximadamente 0.28 nanómetros. Otro ejemplo es el diámetro de un átomo de oxígeno, que es de aproximadamente 0.6 nanómetros, mientras que el diámetro de una molécula de dióxido de carbono es de aproximadamente 0.23 nanómetros.
Conclusión
La respuesta a la pregunta de quién es más grande, un átomo o una molécula, no es tan simple como parece. En términos de volumen, las moléculas pueden ser más grandes debido a su estructura tridimensional, pero en términos de diámetro, los átomos son más pequeños. Además, en términos de masa, las moléculas pueden ser más grandes que los átomos debido a su composición de múltiples átomos.
Preguntas frecuentes
¿Los átomos y moléculas siempre tienen el mismo tamaño?
No, el tamaño de los átomos y las moléculas depende del elemento o compuesto específico.
¿Las moléculas son siempre más grandes que los átomos?
No, en términos de diámetro, los átomos son más pequeños que las moléculas. Pero en términos de volumen, las moléculas pueden ser más grandes debido a su estructura tridimensional.
¿Cuál es la diferencia entre tamaño y masa?
El tamaño se refiere a las dimensiones físicas de un objeto, mientras que la masa se refiere a la cantidad de materia que contiene un objeto.
¿Los átomos y las moléculas se pueden ver con un microscopio?
No, los átomos y las moléculas son demasiado pequeños para ser vistos directamente con un microscopio.
¿Cómo se miden los tamaños de los átomos y las moléculas?
Los tamaños de los átomos y las moléculas se miden en nanómetros, que es una unidad de medida extremadamente pequeña. Se utilizan diferentes técnicas, como la microscopía de fuerza atómica y la difracción de rayos X, para medir estos tamaños.
Deja una respuesta