Orden y clasificación de los elementos en la tabla periódica
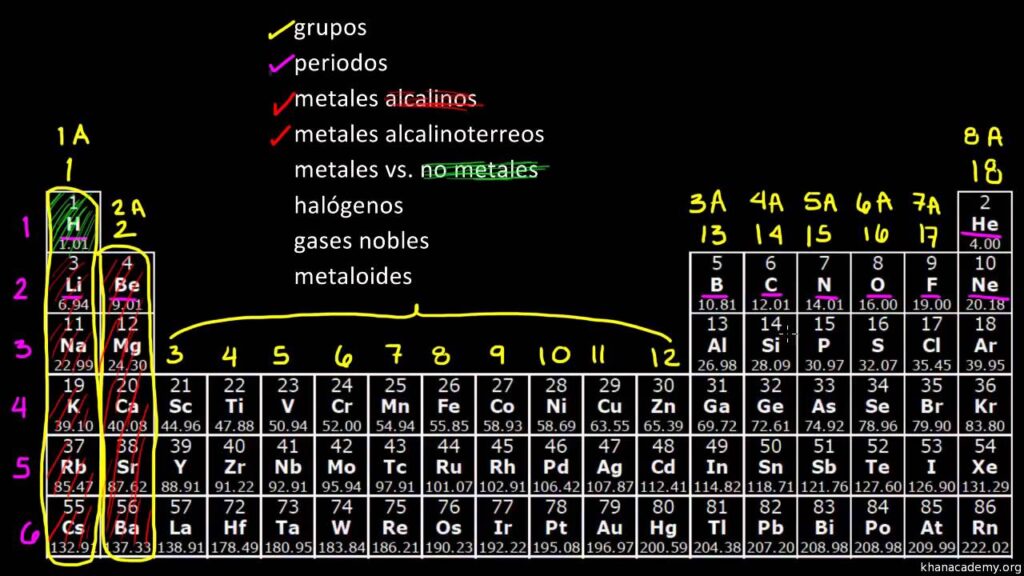
La tabla periódica es una herramienta fundamental en la química, ya que nos permite entender la relación entre los diferentes elementos y su comportamiento químico. Pero ¿cómo se ordenan y clasifican los elementos en la tabla periódica? En este artículo, te explicaremos todo lo que necesitas saber sobre este tema.
Historia de la tabla periódica
La tabla periódica fue creada en 1869 por el químico ruso Dmitri Mendeléyev. Mendeléyev se dio cuenta de que los elementos podían ser ordenados en una tabla basándose en sus propiedades químicas y físicas. En su versión original, Mendeléyev dejó espacios en blanco para elementos que aún no habían sido descubiertos, pero que según su teoría, debían existir.
Con el tiempo, la tabla periódica ha ido evolucionando y mejorando. Hoy en día, la tabla periódica moderna cuenta con 118 elementos químicos, cada uno con su propio símbolo, número atómico y configuración electrónica.
Orden de los elementos en la tabla periódica
Los elementos en la tabla periódica se ordenan en filas horizontales llamadas períodos y en columnas verticales llamadas grupos. Los elementos en un mismo grupo tienen propiedades químicas similares, mientras que los elementos en un mismo período tienen el mismo número de capas electrónicas.
Los grupos de la tabla periódica se numeran del 1 al 18, y se dividen en dos categorías: los metales y los no metales. Los metales se encuentran en la parte izquierda de la tabla periódica y son buenos conductores de calor y electricidad, mientras que los no metales se encuentran en la parte derecha de la tabla periódica y son malos conductores de calor y electricidad.
Clasificación de los elementos en la tabla periódica
Además de la división entre metales y no metales, los elementos en la tabla periódica también se pueden clasificar en diferentes categorías según sus propiedades químicas y físicas. A continuación, te presentamos algunas de las categorías más comunes:
Metales alcalinos
Los metales alcalinos son aquellos que se encuentran en el grupo 1 de la tabla periódica. Estos elementos son muy reactivos y no se encuentran en la naturaleza en estado puro, sino que se encuentran en forma de compuestos. Algunos ejemplos de metales alcalinos son el litio, el sodio y el potasio.
Metales alcalinotérreos
Los metales alcalinotérreos son aquellos que se encuentran en el grupo 2 de la tabla periódica. Estos elementos también son reactivos, pero son menos reactivos que los metales alcalinos. Algunos ejemplos de metales alcalinotérreos son el calcio, el magnesio y el berilio.
Halógenos
Los halógenos son aquellos elementos que se encuentran en el grupo 17 de la tabla periódica. Estos elementos son muy reactivos y forman compuestos con los metales alcalinos. Algunos ejemplos de halógenos son el cloro, el flúor y el yodo.
Gases nobles
Los gases nobles son aquellos elementos que se encuentran en el grupo 18 de la tabla periódica. Estos elementos son muy estables y no reaccionan fácilmente con otros elementos. Algunos ejemplos de gases nobles son el helio, el neón y el argón.
Configuración electrónica de los elementos
La configuración electrónica de un elemento nos indica cómo se distribuyen los electrones en los diferentes niveles de energía alrededor del núcleo del átomo. La configuración electrónica de un elemento nos permite entender su comportamiento químico y su posición en la tabla periódica.
La configuración electrónica se escribe colocando el número de electrones en cada nivel de energía, comenzando por el nivel más cercano al núcleo. Por ejemplo, la configuración electrónica del oxígeno (O) es 1s2 2s2 2p4, lo que indica que tiene dos electrones en el nivel 1, dos electrones en el nivel 2 y cuatro electrones en el nivel 2p.
Conclusión
La tabla periódica es una herramienta fundamental en la química, ya que nos permite entender la relación entre los diferentes elementos y su comportamiento químico. Los elementos en la tabla periódica se ordenan en filas horizontales llamadas períodos y en columnas verticales llamadas grupos. Los elementos en un mismo grupo tienen propiedades químicas similares, mientras que los elementos en un mismo período tienen el mismo número de capas electrónicas.
Preguntas frecuentes
1. ¿Por qué se llaman metales alcalinos?
Los metales alcalinos se llaman así porque al reaccionar con agua, producen soluciones alcalinas.
2. ¿Por qué los gases nobles no reaccionan fácilmente con otros elementos?
Los gases nobles no reaccionan fácilmente con otros elementos porque tienen una configuración electrónica muy estable. Todos sus niveles de energía están llenos de electrones, por lo que no necesitan ganar ni perder electrones para obtener una configuración electrónica estable.
3. ¿Por qué los halógenos son tan reactivos?
Los halógenos son muy reactivos porque tienen una configuración electrónica incompleta en la capa más externa. Al ganar un electrón, pueden completar su capa externa y obtener una configuración electrónica estable.
4. ¿Cuál es el elemento más reactivo de la tabla periódica?
El elemento más reactivo de la tabla periódica es el francio (Fr), que se encuentra en el grupo 1.
5. ¿Por qué se llaman metales alcalinotérreos?
Los metales alcalinotérreos se llaman así porque sus óxidos son básicos (alcalinos) y sus sales son menos solubles que las sales de los metales alcalinos.
Deja una respuesta