De Demócrito a Schrödinger: Evolución de los Modelos Atómicos
Desde la antigua Grecia hasta la era moderna, la humanidad ha intentado comprender la estructura y el funcionamiento de la materia. El estudio de los modelos atómicos ha sido clave en este proceso, y ha evolucionado a lo largo del tiempo gracias a la investigación y el descubrimiento de nuevos fenómenos y teorías.
En este artículo, exploraremos la evolución de los modelos atómicos desde Demócrito hasta Schrödinger, sus principales características y cómo han influido en nuestra comprensión del mundo que nos rodea.
Demócrito y la Teoría Atómica
En el siglo V a.C., el filósofo griego Demócrito propuso por primera vez la teoría atómica, que sostenía que toda la materia estaba compuesta por partículas indivisibles y eternas llamadas átomos. Según Demócrito, estos átomos eran diferentes en forma y tamaño, y se unían y separaban para formar diferentes sustancias.
Aunque la teoría de Demócrito no estaba respaldada por evidencia experimental, sentó las bases para el estudio y la comprensión de la materia a nivel atómico.
El Modelo Atómico de Dalton
En el siglo XIX, el químico británico John Dalton propuso un modelo atómico que se basaba en la teoría de Demócrito. Según Dalton, los átomos eran esferas sólidas e indivisibles, y cada elemento estaba compuesto por átomos del mismo tamaño y forma.
El modelo atómico de Dalton también introdujo la idea de que los átomos se combinaban en proporciones fijas para formar compuestos, lo que sentó las bases para la estequiometría y la química moderna.
El Modelo Atómico de Thomson
A finales del siglo XIX, el físico británico J.J. Thomson descubrió el electrón, una partícula subatómica con carga negativa. En 1904, propuso un nuevo modelo atómico que se basaba en la idea de que los átomos eran esferas cargadas positivamente con electrones incrustados en ellas, como pasas en un pudín.
Este modelo atómico, conocido como el modelo del pudín de pasas, fue el primero en incluir partículas subatómicas y sentó las bases para la teoría del electrón y la estructura atómica.
El Modelo Atómico de Rutherford
En 1911, el físico neozelandés Ernest Rutherford realizó un experimento donde bombardeó una lámina de oro con partículas alfa. Esperaba que las partículas pasaran a través de la lámina sin desviarse, pero descubrió que algunas partículas rebotaban en direcciones inesperadas.
A partir de estos resultados, Rutherford propuso un nuevo modelo atómico en el que los átomos tenían un núcleo pequeño y denso cargado positivamente en el centro, rodeado por electrones que giraban alrededor del núcleo en órbitas circulares.
Este modelo atómico, conocido como el modelo planetario, permitió explicar la distribución de la carga eléctrica en el átomo y sentó las bases para la física nuclear y la energía atómica.
El Modelo Atómico de Bohr
En 1913, el físico danés Niels Bohr propuso un nuevo modelo atómico que mejoraba el modelo planetario de Rutherford. Según Bohr, los electrones solo podían ocupar ciertas órbitas circulares discretas alrededor del núcleo, y los electrones que saltaban de una órbita a otra emitían o absorbían energía en forma de fotones.
Este modelo atómico, conocido como el modelo de Bohr, permitió explicar las líneas espectrales de emisión y absorción de los átomos y sentó las bases para la física cuántica.
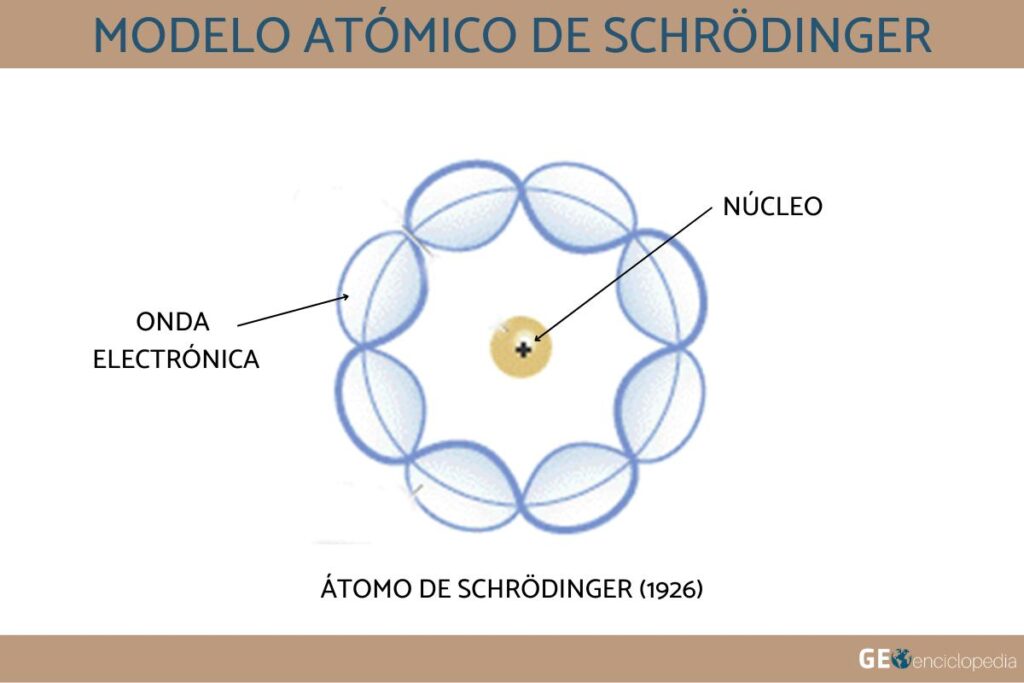
El Modelo Atómico de Schrödinger
En 1926, el físico austriaco Erwin Schrödinger propuso una ecuación matemática que describe la probabilidad de encontrar un electrón en cualquier punto en el espacio alrededor del núcleo. Esta ecuación, conocida como la ecuación de Schrödinger, reemplazó las órbitas circulares del modelo de Bohr con nubes de probabilidad tridimensionales llamadas orbitales.
El modelo atómico de Schrödinger, también conocido como el modelo cuántico, permite explicar la estructura electrónica detallada de los átomos y las moléculas, y es la base de la química cuántica y la nanotecnología.
Conclusión
Desde la teoría atómica de Demócrito hasta el modelo cuántico de Schrödinger, los modelos atómicos han evolucionado a lo largo del tiempo gracias a la investigación y el descubrimiento de nuevos fenómenos y teorías. Cada modelo ha aportado una nueva comprensión de la estructura y el funcionamiento de la materia, y ha sentado las bases para la física y la química modernas.
Preguntas Frecuentes
1. ¿Qué es un modelo atómico?
Un modelo atómico es una representación teórica de la estructura y el funcionamiento de los átomos y las moléculas. Los modelos atómicos se basan en la evidencia experimental y se utilizan para explicar los fenómenos observados en la naturaleza.
2. ¿Cómo han evolucionado los modelos atómicos a lo largo del tiempo?
Los modelos atómicos han evolucionado a lo largo del tiempo gracias a la investigación y el descubrimiento de nuevos fenómenos y teorías. Cada modelo ha aportado una nueva comprensión de la estructura y el funcionamiento de la materia, y ha sentado las bases para la física y la química modernas.
3. ¿Qué es el modelo de Bohr?
El modelo de Bohr es un modelo atómico propuesto por el físico danés Niels Bohr en 1913. Según este modelo, los electrones solo podían ocupar ciertas órbitas circulares discretas alrededor del núcleo, y los electrones que saltaban de una órbita a otra emitían o absorbían energía en forma de fotones.
4. ¿Qué es el modelo cuántico?
El modelo cuántico es un modelo atómico propuesto por el físico austriaco Erwin Schrödinger en 1926. Este modelo se basa en la ecuación de Schrödinger, que describe la probabilidad de encontrar un electrón en cualquier punto en el espacio alrededor del núcleo. El modelo cuántico permite explicar la estructura electrónica detallada de los átomos y las moléculas.
5. ¿Por qué son importantes los modelos atómicos?
Los modelos atómicos son importantes porque nos permiten comprender la estructura y el funcionamiento
Deja una respuesta