Descubre los grupos de la tabla periódica y sus características
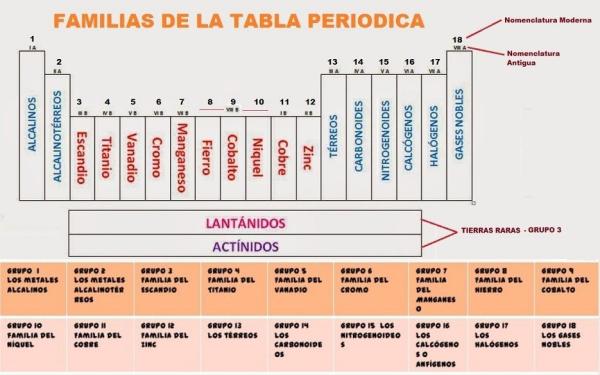
La tabla periódica es una herramienta fundamental en el estudio de la química, ya que nos permite conocer y entender las propiedades de los elementos que existen en la naturaleza. Una de las características más importantes de la tabla periódica es que los elementos están organizados en grupos, los cuales comparten características similares. En este artículo, descubriremos los grupos de la tabla periódica y sus características.
Grupo 1: Los metales alcalinos
El grupo 1 de la tabla periódica está compuesto por los metales alcalinos, los cuales son extremadamente reactivos y se encuentran en estado sólido a temperatura ambiente. Estos elementos tienen un solo electrón en su capa más externa, lo que los hace muy propensos a perderlo y formar iones positivos. Algunas de las características más importantes de los metales alcalinos son su baja densidad, su alta conductividad eléctrica y su capacidad para reaccionar con el agua.
Ejemplos de metales alcalinos:
- Litio (Li)
- Sodio (Na)
- Potasio (K)
- Rubidio (Rb)
- Cesio (Cs)
- Francio (Fr)
Grupo 2: Los metales alcalinotérreos
El grupo 2 de la tabla periódica está compuesto por los metales alcalinotérreos, los cuales también son metales reactivos. Estos elementos tienen dos electrones en su capa más externa, lo que los hace ligeramente menos reactivos que los metales alcalinos. Algunas de las características más importantes de los metales alcalinotérreos son su alta conductividad eléctrica, su baja densidad y su capacidad para formar compuestos iónicos.
Ejemplos de metales alcalinotérreos:
- Berilio (Be)
- Magnesio (Mg)
- Calcio (Ca)
- Estroncio (Sr)
- Bario (Ba)
- Radio (Ra)
Grupo 3-12: Los metales de transición
El grupo 3-12 de la tabla periódica está compuesto por los metales de transición, los cuales son metales duros, resistentes y con alta densidad. Estos elementos tienen varias capas de electrones, lo que les permite tener una gran variedad de estados de oxidación y formar compuestos complejos. Algunas de las características más importantes de los metales de transición son su alta conductividad eléctrica, su resistencia a la corrosión y su capacidad para formar aleaciones.
Ejemplos de metales de transición:
- Titanio (Ti)
- Hierro (Fe)
- Níquel (Ni)
- Cobre (Cu)
- Oro (Au)
- Platino (Pt)
Grupo 13: Los metales del grupo del boro
El grupo 13 de la tabla periódica está compuesto por los metales del grupo del boro, los cuales tienen tres electrones en su capa más externa. Estos elementos tienen propiedades metálicas y no metálicas, lo que les permite formar compuestos complejos. Algunas de las características más importantes de los metales del grupo del boro son su dureza, su punto de fusión elevado y su capacidad para formar compuestos covalentes.
Ejemplos de metales del grupo del boro:
- Boro (B)
- Aluminio (Al)
- Galio (Ga)
- Indio (In)
- Talio (Tl)
Grupo 14: Los metaloides
El grupo 14 de la tabla periódica está compuesto por los metaloides, los cuales tienen propiedades intermedias entre los metales y los no metales. Estos elementos tienen cuatro electrones en su capa más externa, lo que les permite formar compuestos covalentes y iónicos. Algunas de las características más importantes de los metaloides son su dureza, su baja conductividad eléctrica y su capacidad para formar compuestos semiconductores.
Ejemplos de metaloides:
- Carbono (C)
- Silicio (Si)
- Germanio (Ge)
- Arsénico (As)
- Antimonio (Sb)
- Telurio (Te)
Grupo 15: Los no metales
El grupo 15 de la tabla periódica está compuesto por los no metales, los cuales son elementos que no tienen propiedades metálicas. Estos elementos tienen cinco electrones en su capa más externa, lo que les permite formar compuestos covalentes. Algunas de las características más importantes de los no metales son su baja conductividad eléctrica, su bajo punto de fusión y su capacidad para formar compuestos gaseosos.
Ejemplos de no metales:
- Nitrógeno (N)
- Fósforo (P)
- Arsénico (As)
- Antimonio (Sb)
- Bismuto (Bi)
Grupo 16: Los calcógenos
El grupo 16 de la tabla periódica está compuesto por los calcógenos, los cuales son elementos que tienen seis electrones en su capa más externa. Estos elementos tienen propiedades no metálicas, lo que les permite formar compuestos covalentes. Algunas de las características más importantes de los calcógenos son su baja conductividad eléctrica, su capacidad para formar compuestos gaseosos y su toxicidad en altas concentraciones.
Ejemplos de calcógenos:
- Oxígeno (O)
- Azufre (S)
- Selenio (Se)
- Telurio (Te)
- Polonio (Po)
Grupo 17: Los halógenos
El grupo 17 de la tabla periódica está compuesto por los halógenos, los cuales son elementos muy reactivos que tienen siete electrones en su capa más externa. Estos elementos tienen propiedades no metálicas, lo que les permite formar compuestos covalentes. Algunas de las características más importantes de los halógenos son su alta electronegatividad, su capacidad para formar compuestos iónicos y su toxicidad en altas concentraciones.
Ejemplos de halógenos:
- Flúor (F)
- Cloro (Cl)
- Bromo (Br)
- Yodo (I)
- Astato (At)
Grupo 18: Los gases nobles
El grupo 18 de la tabla periódica está compuesto por los gases nobles, los cuales son elementos no reactivos que tienen ocho electrones en su capa más externa. Estos elementos tienen propiedades no metálicas, lo que les permite existir en estado gaseoso a temperatura ambiente. Algunas de las características más importantes de los gases nobles son su baja reactividad, su capacidad para formar compuestos débiles y su uso en iluminación y refrigeración.
Ejemplos de gases nobles:
- Helio (He)
- Neón (Ne)
- Argón (Ar)
- Criptón (Kr)
- Xenón (Xe)
- Radón (Rn)
Conclusión
La tabla peri
Deja una respuesta