Niveles energéticos del aluminio: distribución de electrones
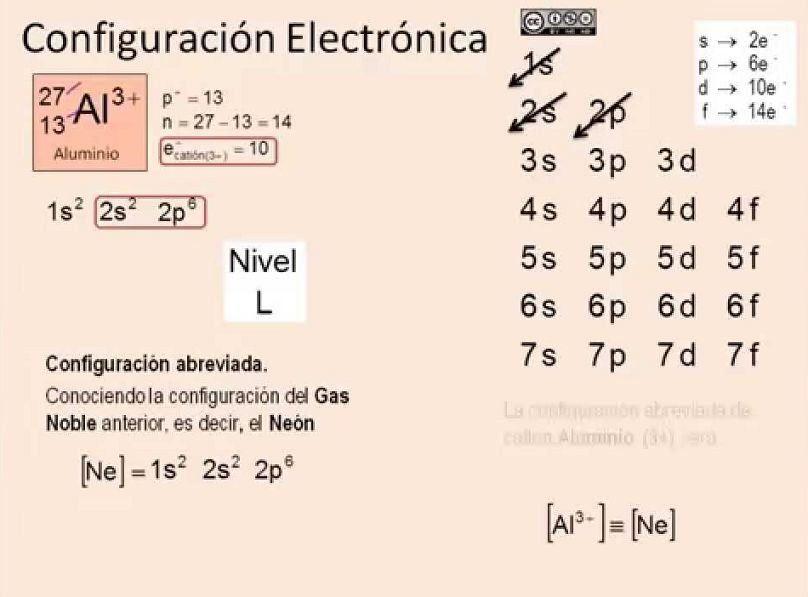
El aluminio es uno de los elementos más utilizados en la industria moderna debido a su alta resistencia y ligereza. Pero, ¿sabes cómo se distribuyen los electrones en los niveles energéticos del aluminio? En este artículo te lo explicaremos con detalle.
¿Qué son los niveles energéticos?
Antes de profundizar en la distribución de los electrones en los niveles energéticos del aluminio, es importante entender qué son los niveles energéticos en sí mismos. Los átomos están compuestos por un núcleo central que contiene protones y neutrones, rodeado por electrones que se mueven a diferentes niveles de energía.
Los niveles de energía son capas que rodean el núcleo de un átomo y que contienen electrones con diferentes niveles de energía. Los electrones se distribuyen en estos niveles de acuerdo con las reglas de configuración electrónica.
Distribución de los electrones en los niveles energéticos del aluminio
El aluminio tiene un número atómico de 13, lo que significa que tiene 13 protones en su núcleo. Los electrones se distribuyen en cuatro niveles energéticos: K, L, M y N.
El nivel K es el más cercano al núcleo y puede contener un máximo de dos electrones. El nivel L puede contener hasta ocho electrones, el nivel M hasta 18 electrones y el nivel N hasta 3 electrones.
La distribución de electrones en los niveles energéticos del aluminio es la siguiente:
- Nivel K: 2 electrones
- Nivel L: 8 electrones
- Nivel M: 3 electrones
- Nivel N: 0 electrones
La distribución electrónica del aluminio es 1s2 2s2 2p6 3s2 3p1. Esto significa que los dos primeros electrones se encuentran en el nivel K, los siguientes ocho electrones se encuentran en el nivel L, los siguientes dos electrones se encuentran en el nivel M y el último electrón se encuentra en el nivel N.
¿Qué son los orbitales?
Para entender mejor la distribución de los electrones en los niveles energéticos del aluminio, es importante conocer los orbitales. Los orbitales son regiones del espacio alrededor del núcleo donde es probable que se encuentren los electrones.
Cada nivel energético está compuesto por orbitales que tienen diferentes formas y tamaños. Los electrones se distribuyen en estos orbitales de acuerdo a las reglas de configuración electrónica.
Reglas de configuración electrónica
Las reglas de configuración electrónica son un conjunto de reglas que describen cómo se distribuyen los electrones en los niveles energéticos y los orbitales. Estas reglas son muy importantes para comprender la estructura electrónica de los átomos y moléculas.
Las reglas de configuración electrónica son las siguientes:
- Regla de Aufbau: los electrones se llenan en los orbitales de menor energía primero antes de llenar los orbitales de mayor energía.
- Regla de Hund: cuando hay varios orbitales con la misma energía, los electrones se distribuyen en diferentes orbitales antes de emparejarse.
- Regla de Pauli: cada orbital puede contener un máximo de dos electrones con espines opuestos.
Conclusión
La distribución de electrones en los niveles energéticos del aluminio es 1s2 2s2 2p6 3s2 3p1. Los electrones se distribuyen en cuatro niveles energéticos: K, L, M y N, y en diferentes orbitales de acuerdo con las reglas de configuración electrónica.
Esperamos que este artículo te haya ayudado a comprender mejor la estructura electrónica del aluminio y cómo se distribuyen los electrones en sus niveles energéticos.
Preguntas frecuentes
1. ¿Cuántos electrones tiene el aluminio en su nivel K?
El aluminio tiene dos electrones en su nivel K.
2. ¿Qué es un orbital?
Un orbital es una región del espacio alrededor del núcleo donde es probable que se encuentren los electrones.
3. ¿Qué son las reglas de configuración electrónica?
Las reglas de configuración electrónica son un conjunto de reglas que describen cómo se distribuyen los electrones en los niveles energéticos y los orbitales.
4. ¿Cuántos niveles energéticos tiene el aluminio?
El aluminio tiene cuatro niveles energéticos: K, L, M y N.
5. ¿Qué es la regla de Hund?
La regla de Hund establece que cuando hay varios orbitales con la misma energía, los electrones se distribuyen en diferentes orbitales antes de emparejarse.
Deja una respuesta