Domina la regla del octeto y estructura de Lewis para el Exani II
Si estás preparándote para el Examen Nacional de Ingreso a la Educación Superior (Exani II), es importante que conozcas la regla del octeto y la estructura de Lewis. Estos conceptos son fundamentales en la química y son aplicables en muchos temas, desde la formación de enlaces químicos hasta la comprensión de la reactividad de los elementos.
En este artículo, te explicaremos de manera sencilla y clara qué es la regla del octeto y la estructura de Lewis, y cómo puedes aplicar estos conceptos en el Exani II.
¿Qué es la regla del octeto?
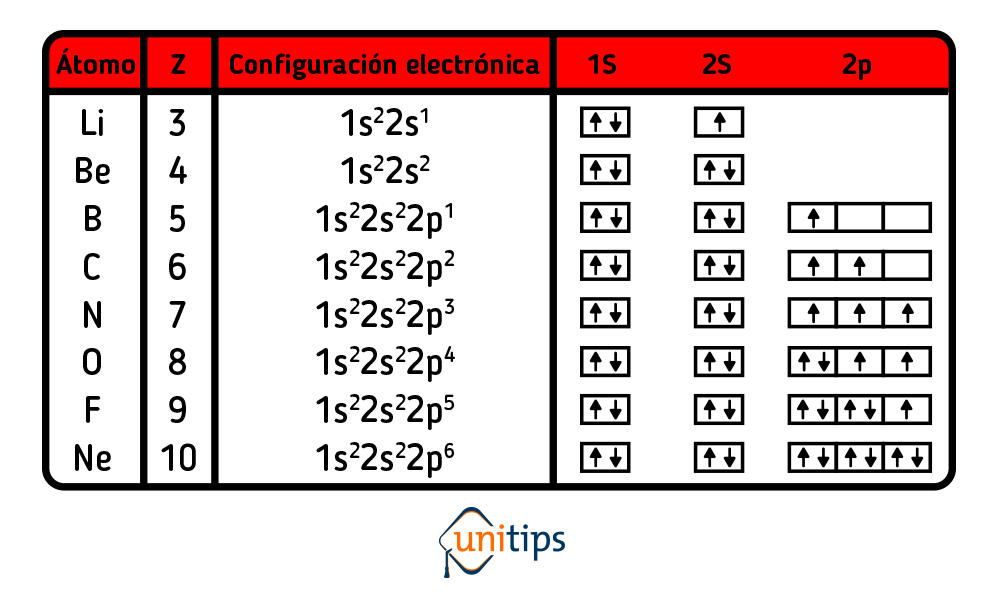
La regla del octeto es una teoría que establece que los átomos tienden a completar su estructura electrónica con ocho electrones en su capa de valencia, es decir, la capa más externa de electrones. Esta regla se basa en la observación de que los elementos químicos se combinan para formar enlaces químicos con el fin de alcanzar una configuración electrónica estable similar a la de los gases nobles.
Los gases nobles, como el helio, neón y argón, tienen una configuración electrónica completa en su capa de valencia, lo que los hace muy estables y poco reactivos. Los demás elementos químicos tratan de imitar esta configuración electrónica completa para conseguir estabilidad.
¿Qué es la estructura de Lewis?
La estructura de Lewis es una representación gráfica que muestra los electrones de valencia de un átomo y cómo se comparten o se transfieren en un enlace químico. Fue desarrollada por el químico estadounidense Gilbert N. Lewis en 1916 y es una herramienta útil para predecir la estructura molecular de las moléculas.
En la estructura de Lewis, los electrones de valencia se representan como puntos alrededor del símbolo del átomo. Los enlaces covalentes se representan como líneas que conectan los átomos y los pares de electrones no compartidos se representan como puntos solitarios.
¿Cómo se aplican la regla del octeto y la estructura de Lewis en el Exani II?
En el Exani II, es común que se te pregunte acerca de la formación de enlaces químicos y la estructura molecular de las moléculas. Para responder estas preguntas, es necesario que tengas un buen dominio de la regla del octeto y la estructura de Lewis.
Por ejemplo, si se te pide que determines la estructura molecular del dióxido de carbono (CO2), debes seguir los siguientes pasos:
1. Determina la estructura de Lewis de cada átomo. El carbono tiene cuatro electrones de valencia y el oxígeno tiene seis electrones de valencia.
2. Coloca los átomos en la posición adecuada para formar la molécula. El carbono debe estar en el centro y los dos átomos de oxígeno deben estar a su alrededor.
3. Comparte electrones de valencia para formar enlaces covalentes. El carbono comparte dos electrones con cada átomo de oxígeno, lo que resulta en dos enlaces covalentes por cada átomo de oxígeno.
4. Completa la estructura de Lewis de la molécula. Los enlaces covalentes se representan como líneas y los pares solitarios se representan como puntos.
5. Determina la geometría molecular. En el caso del CO2, la geometría molecular es lineal.
Conclusión
La regla del octeto y la estructura de Lewis son conceptos fundamentales en la química y son aplicables en muchos temas del Exani II. Es importante que tengas un buen dominio de estos conceptos para poder responder preguntas relacionadas con la formación de enlaces químicos y la estructura molecular de las moléculas.
Preguntas frecuentes
¿Por qué se llama regla del octeto?
Se llama regla del octeto porque establece que los átomos tienden a completar su estructura electrónica con ocho electrones en su capa de valencia.
¿Qué es un enlace covalente?
Un enlace covalente es un tipo de enlace químico en el que dos átomos comparten uno o más pares de electrones de valencia.
¿Qué es un par solitario?
Un par solitario es un par de electrones de valencia que no se comparten en un enlace químico.
¿Qué es la geometría molecular?
La geometría molecular se refiere a la disposición tridimensional de los átomos en una molécula.
¿Cómo se determina la geometría molecular?
La geometría molecular se determina mediante la ubicación de los átomos y los pares solitarios en la estructura de Lewis de la molécula.
Deja una respuesta