Descubre la ley fundamental: la primera ley de la termodinámica
La termodinámica es una rama de la física que se encarga del estudio del calor y la energía. En esta disciplina, se han establecido varias leyes que rigen el comportamiento de la materia y la energía en los sistemas termodinámicos. Entre estas leyes, la primera ley de la termodinámica es considerada la ley fundamental y es de vital importancia para el estudio de la termodinámica.
- ¿Qué es la primera ley de la termodinámica?
- ¿Cómo se aplica la primera ley de la termodinámica?
- ¿Cuál es la importancia de la primera ley de la termodinámica?
- ¿Cómo se expresa la primera ley de la termodinámica matemáticamente?
- ¿Qué es la energía interna en un sistema termodinámico?
- ¿Qué es el trabajo en un sistema termodinámico?
- Conclusion
- Preguntas frecuentes
- 1. ¿La primera ley de la termodinámica se aplica solo a sistemas cerrados?
- 2. ¿Qué es la entalpía en un sistema termodinámico?
- 3. ¿La primera ley de la termodinámica se aplica a procesos reversibles e irreversibles?
- 4. ¿Por qué se llama la primera ley de la termodinámica la ley de la conservación de la energía?
- 5. ¿La primera ley de la termodinámica se aplica solo a sistemas en equilibrio?
¿Qué es la primera ley de la termodinámica?
La primera ley de la termodinámica, también conocida como la ley de la conservación de la energía, establece que la energía no puede ser creada ni destruida, solo puede ser transformada de una forma a otra. Esta ley es fundamental para entender cómo se comporta la energía en los sistemas termodinámicos y cómo se puede utilizar para realizar trabajo.
¿Cómo se aplica la primera ley de la termodinámica?
La primera ley de la termodinámica se aplica en muchos procesos físicos y químicos. Por ejemplo, en un motor de combustión interna, la energía química almacenada en el combustible se convierte en energía térmica que se utiliza para impulsar un pistón y generar trabajo. En un refrigerador, la energía eléctrica se utiliza para extraer el calor del interior del refrigerador y expulsarlo al ambiente exterior.
¿Cuál es la importancia de la primera ley de la termodinámica?
La primera ley de la termodinámica es de vital importancia para entender cómo se comporta la energía en los sistemas termodinámicos y cómo se puede utilizar para realizar trabajo. Esta ley es fundamental para el diseño y la optimización de sistemas energéticos, como motores, turbinas, refrigeradores y sistemas de generación de energía eléctrica.
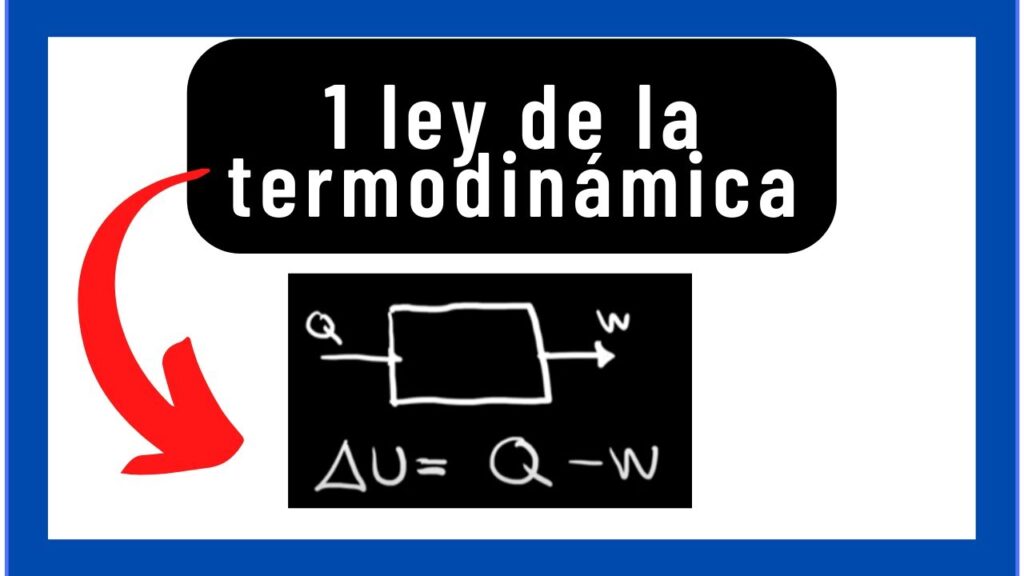
¿Cómo se expresa la primera ley de la termodinámica matemáticamente?
La primera ley de la termodinámica se puede expresar matemáticamente como:
ΔU = Q - W
Donde ΔU es el cambio en la energía interna del sistema, Q es el calor transferido al sistema y W es el trabajo realizado por el sistema. Esta ecuación establece que el cambio en la energía interna del sistema es igual a la diferencia entre el calor transferido al sistema y el trabajo realizado por el sistema.
¿Qué es la energía interna en un sistema termodinámico?
La energía interna es la energía total contenida en un sistema termodinámico. Esta energía incluye la energía cinética de las moléculas del sistema, la energía potencial de las fuerzas intermoleculares y la energía de las interacciones entre las moléculas del sistema. La energía interna de un sistema termodinámico depende de la temperatura, la presión y el volumen del sistema.
¿Qué es el trabajo en un sistema termodinámico?
El trabajo en un sistema termodinámico es la energía transferida al sistema como resultado de una fuerza que actúa a través de una distancia. En un sistema termodinámico, el trabajo se puede realizar en forma de expansión o compresión del sistema, lo que puede cambiar su volumen y presión. El trabajo también se puede realizar en forma de transferencia de calor de un sistema a otro.
Conclusion
La primera ley de la termodinámica es la ley fundamental que rige el comportamiento de la energía en los sistemas termodinámicos. Esta ley establece que la energía no puede ser creada ni destruida, solo puede ser transformada de una forma a otra. Es esencial para entender cómo se comporta la energía en los sistemas termodinámicos y cómo se puede utilizar para realizar trabajo. Además, es fundamental para el diseño y la optimización de sistemas energéticos.
Preguntas frecuentes
1. ¿La primera ley de la termodinámica se aplica solo a sistemas cerrados?
No necesariamente. La primera ley de la termodinámica se aplica a cualquier sistema termodinámico, ya sea cerrado o abierto, siempre y cuando se tenga en cuenta la transferencia de energía a través de las fronteras del sistema.
2. ¿Qué es la entalpía en un sistema termodinámico?
La entalpía es una propiedad termodinámica que representa la cantidad de energía total contenida en un sistema termodinámico, incluyendo la energía interna y la energía de la presión y el volumen.
3. ¿La primera ley de la termodinámica se aplica a procesos reversibles e irreversibles?
Sí, la primera ley de la termodinámica se aplica tanto a procesos reversibles como a procesos irreversibles. Sin embargo, el trabajo realizado en un proceso irreversible no es necesariamente igual al trabajo realizado en un proceso reversible.
4. ¿Por qué se llama la primera ley de la termodinámica la ley de la conservación de la energía?
La primera ley de la termodinámica establece que la energía no puede ser creada ni destruida, solo puede ser transformada de una forma a otra. Esta ley es esencialmente una expresión de la ley de la conservación de la energía, que establece que la energía total en un sistema aislado se mantiene constante.
5. ¿La primera ley de la termodinámica se aplica solo a sistemas en equilibrio?
No necesariamente. La primera ley de la termodinámica se aplica a cualquier sistema termodinámico, ya sea en equilibrio o no, siempre y cuando se tenga en cuenta la transferencia de energía a través de las fronteras del sistema.
Deja una respuesta