Descubre los procesos termodinámicos adiabáticos y no adiabáticos
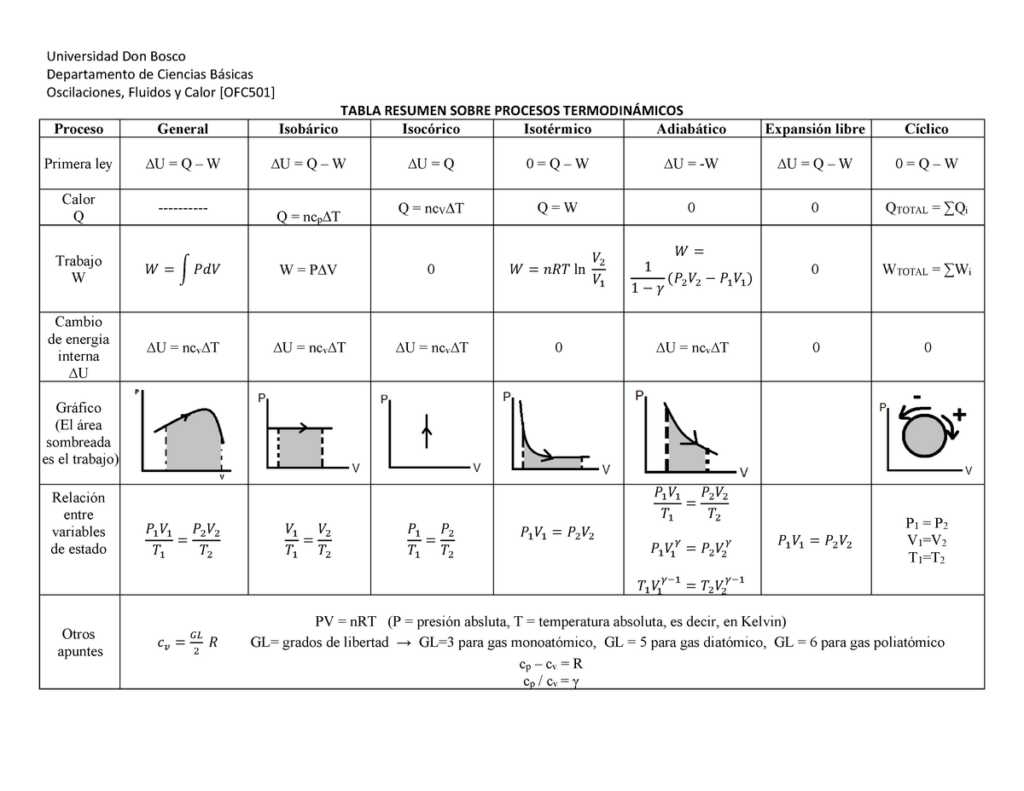
Cuando hablamos de procesos termodinámicos, nos referimos a los cambios que experimentan los sistemas termodinámicos en cuanto a sus propiedades físicas. Estos procesos pueden ser de diferentes tipos, como los adiabáticos y no adiabáticos. En este artículo, te explicaremos en qué consisten estos procesos y cuáles son sus diferencias.
¿Qué es un proceso termodinámico?
Para entender los procesos termodinámicos adiabáticos y no adiabáticos, primero debemos entender qué es un proceso termodinámico. En términos generales, un proceso termodinámico es cualquier cambio que experimenta un sistema termodinámico en cuanto a sus propiedades físicas. Estos cambios pueden implicar una transferencia de energía o una variación en la presión, el volumen o la temperatura.
¿Qué es un proceso termodinámico adiabático?
Un proceso termodinámico adiabático es aquel en el que no hay intercambio de calor entre el sistema y su entorno. Esto significa que el sistema no recibe ni pierde energía térmica durante el proceso. En otras palabras, la energía interna del sistema se mantiene constante.
Un ejemplo de un proceso adiabático es el enfriamiento rápido de un gas comprimido en un cilindro con un pistón. El gas se comprime rápidamente, lo que aumenta su temperatura, pero como no hay intercambio de calor con el entorno, la energía interna del gas se mantiene constante. A medida que el gas se expande, se enfría debido a la disminución de la temperatura.
¿Qué es un proceso termodinámico no adiabático?
Un proceso termodinámico no adiabático es aquel en el que sí hay intercambio de calor entre el sistema y su entorno. En este tipo de procesos, la energía interna del sistema puede variar debido a la transferencia de calor.
Un ejemplo de un proceso no adiabático es la cocción de alimentos en un horno. El calor se transfiere del horno al alimento, lo que aumenta su temperatura y su energía interna. A medida que el alimento se cocina, su temperatura y su energía interna aumentan aún más debido a la transferencia de calor.
¿Cuáles son las diferencias entre los procesos adiabáticos y no adiabáticos?
La principal diferencia entre los procesos adiabáticos y no adiabáticos es que en los primeros no hay intercambio de calor entre el sistema y su entorno, mientras que en los segundos sí lo hay. Esta diferencia tiene importantes consecuencias en cuanto a la variación de las propiedades físicas del sistema.
En los procesos adiabáticos, la energía interna del sistema se mantiene constante, lo que implica que la temperatura y la presión pueden variar. Por ejemplo, si comprimimos rápidamente un gas en un cilindro con un pistón, su temperatura y su presión aumentarán debido a la disminución del volumen, pero su energía interna se mantendrá constante.
En los procesos no adiabáticos, la energía interna del sistema puede variar debido a la transferencia de calor. Esto implica que la temperatura y la presión pueden variar de manera diferente a como lo hacen en los procesos adiabáticos. Por ejemplo, si calentamos un gas en un recipiente cerrado, su temperatura y su presión aumentarán debido a la transferencia de calor desde el entorno, pero su volumen se mantendrá constante.
Conclusión
Los procesos termodinámicos adiabáticos y no adiabáticos son dos tipos diferentes de cambios que pueden experimentar los sistemas termodinámicos. En los procesos adiabáticos, no hay intercambio de calor entre el sistema y su entorno, mientras que en los procesos no adiabáticos sí lo hay. Estas diferencias tienen importantes consecuencias en cuanto a la variación de las propiedades físicas del sistema, como la temperatura, la presión y el volumen.
Preguntas frecuentes
1. ¿Qué es un sistema termodinámico?
Un sistema termodinámico es cualquier objeto o conjunto de objetos que se estudia en términos de sus propiedades físicas, como la temperatura, la presión y el volumen.
2. ¿Qué es la energía interna de un sistema termodinámico?
La energía interna de un sistema termodinámico es la suma de todas las formas de energía que poseen sus partículas, como la energía cinética y la energía potencial.
3. ¿Qué es la transferencia de calor?
La transferencia de calor es el movimiento de energía térmica desde un cuerpo con mayor temperatura a otro con menor temperatura.
4. ¿Qué es la compresión de un gas?
La compresión de un gas es el proceso mediante el cual se reduce el volumen ocupado por el gas, aumentando su densidad y su presión.
5. ¿Qué es la expansión de un gas?
La expansión de un gas es el proceso mediante el cual se aumenta el volumen ocupado por el gas, disminuyendo su densidad y su presión.
Deja una respuesta