La primera ley de la termodinámica: ¡Descubre su ecuación fundamental!
La termodinámica es una rama de la física que estudia la relación entre la energía y la materia. La primera ley de la termodinámica, también conocida como la ley de conservación de la energía, establece que la energía no se crea ni se destruye, solo se transforma de una forma a otra. En este artículo, exploraremos la ecuación fundamental de la primera ley de la termodinámica y cómo se aplica en situaciones cotidianas.
- ¿Qué es la primera ley de la termodinámica?
- La ecuación fundamental de la primera ley de la termodinámica
- Aplicaciones cotidianas de la primera ley de la termodinámica
- 5 preguntas frecuentes sobre la primera ley de la termodinámica
- 1. ¿Es la primera ley de la termodinámica aplicable a todos los sistemas?
- 2. ¿Qué es la energía interna de un sistema?
- 3. ¿Qué es el trabajo en términos de la primera ley de la termodinámica?
- 4. ¿Qué es el calor en términos de la primera ley de la termodinámica?
- 5. ¿La primera ley de la termodinámica contradice la segunda ley de la termodinámica?
- Conclusión
¿Qué es la primera ley de la termodinámica?
La primera ley de la termodinámica establece que la energía total en un sistema aislado es constante. Esto significa que la cantidad total de energía en un sistema no cambia, solo se transforma de una forma a otra. Por ejemplo, si un objeto se mueve, la energía cinética se transforma en energía potencial a medida que el objeto se eleva. La primera ley de la termodinámica también se aplica a los sistemas abiertos, como el cuerpo humano, donde la energía entra y sale del sistema.
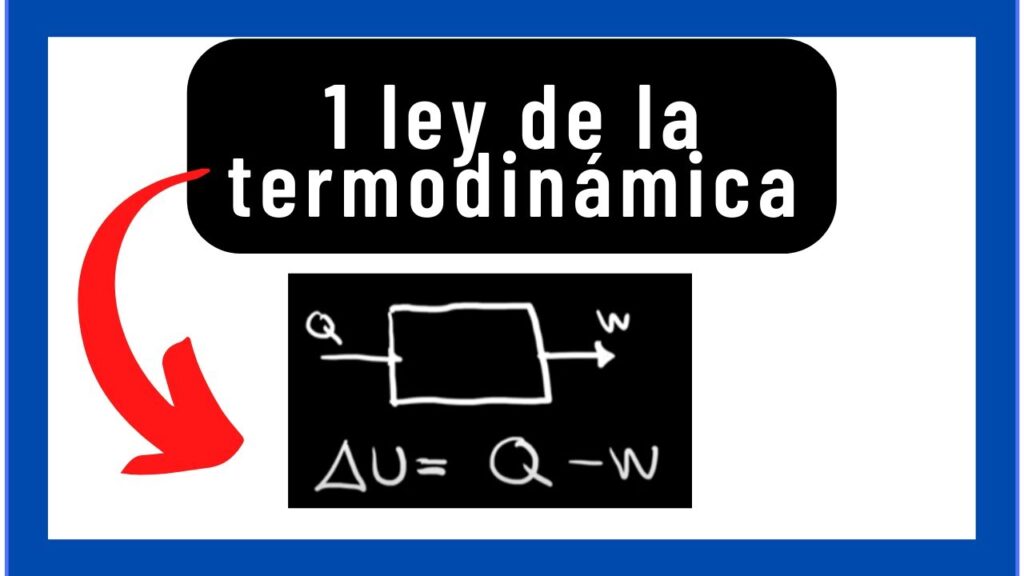
La ecuación fundamental de la primera ley de la termodinámica
La ecuación fundamental de la primera ley de la termodinámica es la siguiente:
ΔU = Q - W
Donde:
- ΔU: Cambio en la energía interna del sistema
- Q: Cantidad de calor que entra al sistema
- W: Trabajo realizado por el sistema
Esta ecuación establece que la variación de la energía interna de un sistema es igual a la cantidad de calor que entra al sistema menos el trabajo realizado por el sistema. Si el valor de ΔU es positivo, significa que la energía interna del sistema ha aumentado. Si es negativo, significa que la energía interna ha disminuido.
Aplicaciones cotidianas de la primera ley de la termodinámica
La primera ley de la termodinámica se aplica en una amplia variedad de situaciones cotidianas. Algunos ejemplos incluyen:
- Un motor de combustión interna: La energía química de la gasolina se convierte en energía térmica en el motor, que luego se convierte en energía mecánica para hacer que el vehículo se mueva.
- Una taza de café caliente: La energía térmica del café caliente se transfiere al aire más frío a medida que la taza se enfría, lo que significa que la energía total del sistema se mantiene constante.
- Un horno: La energía eléctrica se convierte en energía térmica en el horno, lo que permite cocinar los alimentos.
5 preguntas frecuentes sobre la primera ley de la termodinámica
1. ¿Es la primera ley de la termodinámica aplicable a todos los sistemas?
Sí, la primera ley de la termodinámica se aplica a todos los sistemas, ya sean cerrados o abiertos.
2. ¿Qué es la energía interna de un sistema?
La energía interna de un sistema es la energía total asociada con las moléculas y átomos que componen el sistema.
3. ¿Qué es el trabajo en términos de la primera ley de la termodinámica?
El trabajo en términos de la primera ley de la termodinámica se refiere a la energía que se utiliza para realizar una tarea, como mover un objeto o comprimir un gas.
4. ¿Qué es el calor en términos de la primera ley de la termodinámica?
El calor en términos de la primera ley de la termodinámica se refiere a la energía térmica que se transfiere de un objeto a otro debido a una diferencia de temperatura.
5. ¿La primera ley de la termodinámica contradice la segunda ley de la termodinámica?
No, la primera ley de la termodinámica y la segunda ley de la termodinámica son dos leyes diferentes que se aplican en diferentes situaciones. Mientras que la primera ley se enfoca en la conservación de la energía, la segunda ley se enfoca en la dirección en la que ocurren los procesos termodinámicos.
Conclusión
La primera ley de la termodinámica es una ley fundamental de la física que establece que la energía no se crea ni se destruye, solo se transforma de una forma a otra. La ecuación fundamental de la primera ley de la termodinámica establece que la variación de la energía interna de un sistema es igual a la cantidad de calor que entra al sistema menos el trabajo realizado por el sistema. Esta ley se aplica en una amplia variedad de situaciones cotidianas, desde motores de combustión interna hasta tazas de café caliente.
Deja una respuesta