Descubre los números de oxidación de los elementos: Tabla Periódica
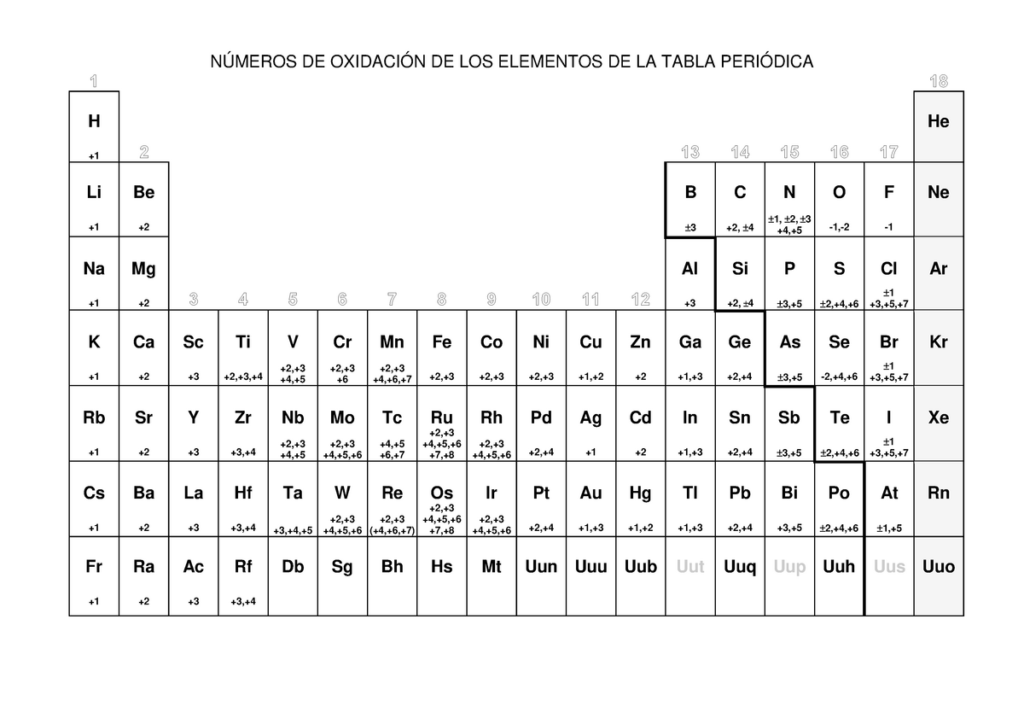
La tabla periódica es una herramienta muy valiosa para comprender la química de los elementos y sus propiedades. Una de las características importantes de cada elemento es su número de oxidación o estado de oxidación, que es la carga que el átomo tendría si todos los electrones compartidos en los enlaces químicos se transfirieran por completo a los átomos más electronegativos.
El número de oxidación es esencial para entender cómo los elementos reaccionan y forman compuestos químicos. Por ejemplo, el hidrógeno tiene un número de oxidación de +1 cuando se combina con no metales, pero de -1 cuando se combina con metales.
A continuación, se presenta una tabla periódica que muestra los números de oxidación más comunes de cada elemento:
Tabla periódica de los números de oxidación
| Elemento | Número de oxidación más común |
|---|---|
| Hidrógeno | +1, -1 |
| Helio | 0 |
| Litio | +1 |
| Berilio | +2 |
| Boro | +3 |
| Carbono | +4, -4 |
| Nitrógeno | +5, +4, +3, +2, -3 |
| Oxígeno | -2 |
| Flúor | -1 |
| Neón | 0 |
| Sodio | +1 |
| Magnesio | +2 |
| Aluminio | +3 |
| Silicio | +4 |
| Fósforo | +5, +3 |
| Azufre | +6, +4, -2 |
| Cloro | +7, +5, +3, +1, -1 |
| Argón | 0 |
¿Cómo se determinan los números de oxidación?
El número de oxidación se determina mediante la regla de que la suma de los números de oxidación de los átomos en una molécula o compuesto debe ser igual a cero para una molécula neutra, o igual a la carga del ion en el caso de un ion.
Por ejemplo, en el compuesto H2O, la suma de los números de oxidación debe ser cero. El oxígeno tiene un número de oxidación de -2, por lo que los dos átomos de hidrógeno deben tener un número de oxidación de +1 para que la suma sea cero.
¿Por qué son importantes los números de oxidación?
Los números de oxidación son importantes porque nos permiten predecir cómo los elementos reaccionarán para formar compuestos. Por ejemplo, sabemos que el sodio tiene un número de oxidación de +1 y el cloro tiene un número de oxidación de -1. Por lo tanto, podemos predecir que cuando el sodio y el cloro reaccionan, el sodio perderá un electrón y el cloro ganará un electrón, formando el compuesto iónico NaCl.
¿Los números de oxidación siempre son los mismos?
No, los números de oxidación pueden variar dependiendo del compuesto o la molécula en la que se encuentran los átomos. Por ejemplo, el nitrógeno puede tener un número de oxidación de +5 en el compuesto nitrato (NO3-), pero un número de oxidación de -3 en el compuesto amoníaco (NH3).
¿Cómo se usan los números de oxidación en la vida cotidiana?
Los números de oxidación son importantes en muchos campos, como la química, la medicina y la ingeniería. Por ejemplo, los números de oxidación se utilizan para entender cómo los contaminantes en el aire y el agua pueden afectar la salud humana. También se utilizan para diseñar y fabricar materiales que sean seguros y eficientes.
¿Qué es la oxidación-reducción?
La oxidación-reducción es una reacción química en la que los electrones se transfieren de un átomo a otro. La oxidación es la pérdida de electrones y la reducción es la ganancia de electrones. La oxidación-reducción es importante en muchos procesos biológicos, como la respiración celular y la fotosíntesis.
Conclusión
Los números de oxidación son una parte importante de la química y nos permiten predecir cómo los elementos reaccionarán para formar compuestos. La tabla periódica de los números de oxidación es una herramienta útil para comprender los números de oxidación más comunes de cada elemento. Al entender los números de oxidación, podemos comprender mejor cómo los elementos reaccionan y cómo se pueden utilizar en la vida cotidiana.
Deja una respuesta