Ley de conservación de la masa: todo lo que necesitas saber
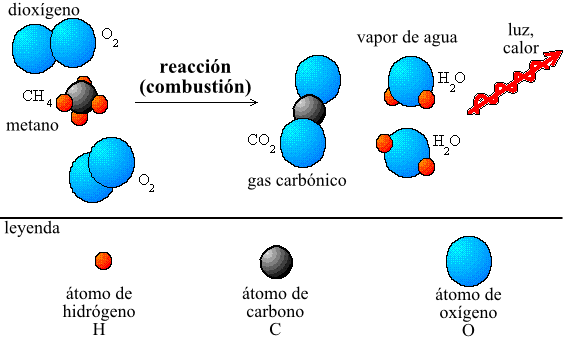
Cuando hablamos de química, una de las leyes más importantes que debemos conocer es la ley de conservación de la masa. Esta ley es fundamental para entender cómo se producen las reacciones químicas y cómo se relacionan las diferentes sustancias entre sí. En este artículo, te explicaremos todo lo que necesitas saber sobre la ley de conservación de la masa, desde su definición hasta su aplicación en la vida real.
¿Qué es la ley de conservación de la masa?
La ley de conservación de la masa, también conocida como ley de Lavoisier en honor al químico francés Antoine Lavoisier, establece que en una reacción química, la masa total de los productos es igual a la masa total de los reactivos. En otras palabras, la cantidad de materia que se tiene al inicio de una reacción química es la misma que la cantidad de materia que se tiene al final de la misma. Esta ley se basa en la idea de que la materia no se crea ni se destruye, sino que simplemente se transforma.
¿Cómo se aplica la ley de conservación de la masa?
La ley de conservación de la masa se aplica en todas las reacciones químicas, ya sean simples o complejas. Para entender cómo se aplica esta ley, es útil utilizar un ejemplo sencillo. Imagina que tienes una vela y la enciendes. La vela se va consumiendo poco a poco, y al final queda solo un poco de cera y una pequeña cantidad de cenizas. Si pesas la vela antes y después de haberla encendido, verás que la masa total es la misma. La cera se ha transformado en gas y en cenizas, pero la masa total sigue siendo la misma.
De manera similar, en una reacción química simple como la combustión del hidrógeno, la masa total de los reactivos (hidrógeno y oxígeno) es igual a la masa total de los productos (agua). La fórmula para esta reacción química es la siguiente:
2H2 + O2 -> 2H2O
En esta reacción, la masa total de los reactivos (2 moles de hidrógeno y 1 mol de oxígeno) es igual a la masa total de los productos (2 moles de agua). La ley de conservación de la masa se cumple en todo momento.
¿Por qué es importante la ley de conservación de la masa?
La ley de conservación de la masa es importante porque nos permite entender cómo se producen las reacciones químicas y cómo se relacionan las diferentes sustancias entre sí. Al conocer esta ley, podemos prever qué productos se obtendrán a partir de ciertos reactivos, y podemos calcular las cantidades exactas de cada sustancia que se necesitan para obtener los resultados deseados. Además, esta ley es fundamental para la investigación y el desarrollo de nuevos materiales y productos químicos.
¿Cómo se verifica la ley de conservación de la masa?
Para verificar la ley de conservación de la masa en una reacción química, es necesario medir la masa de los reactivos antes de la reacción y la masa de los productos después de la misma. Si la masa total de los productos es igual a la masa total de los reactivos, entonces se cumple la ley de conservación de la masa. Esta verificación se realiza en laboratorios de química y es fundamental para garantizar la precisión de los resultados obtenidos.
Aplicaciones prácticas de la ley de conservación de la masa
La ley de conservación de la masa tiene muchas aplicaciones prácticas en la vida real. Algunas de ellas son las siguientes:
- En la industria alimentaria, se utiliza la ley de conservación de la masa para calcular las cantidades exactas de ingredientes que se necesitan para producir ciertos alimentos.
- En la producción de medicamentos, la ley de conservación de la masa se utiliza para garantizar que se obtengan las cantidades exactas de cada sustancia necesaria.
- En la industria petrolera, se utiliza la ley de conservación de la masa para prever qué productos se obtendrán a partir de ciertos hidrocarburos.
- En la investigación científica, la ley de conservación de la masa se utiliza para entender cómo se producen ciertas reacciones químicas y para desarrollar nuevos materiales y productos.
Conclusión
La ley de conservación de la masa es una de las leyes fundamentales de la química. Esta ley establece que en una reacción química, la masa total de los productos es igual a la masa total de los reactivos. Gracias a esta ley, podemos entender cómo se producen las reacciones químicas y cómo se relacionan las diferentes sustancias entre sí. Además, la ley de conservación de la masa tiene muchas aplicaciones prácticas en la vida real, desde la producción de alimentos hasta la investigación científica.
Preguntas frecuentes
¿Qué es la ley de conservación de la masa?
La ley de conservación de la masa establece que en una reacción química, la masa total de los productos es igual a la masa total de los reactivos.
¿Por qué es importante la ley de conservación de la masa?
La ley de conservación de la masa es importante porque nos permite entender cómo se producen las reacciones químicas y cómo se relacionan las diferentes sustancias entre sí.
¿Cómo se verifica la ley de conservación de la masa?
Para verificar la ley de conservación de la masa en una reacción química, es necesario medir la masa de los reactivos antes de la reacción y la masa de los productos después de la misma.
¿Cuáles son las aplicaciones prácticas de la ley de conservación de la masa?
La ley de conservación de la masa tiene muchas aplicaciones prácticas en la vida real, desde la producción de alimentos hasta la investigación científica.
¿Qué pasaría si no se cumpliera la ley de conservación de la masa?
Si no se cumpliera la ley de conservación de la masa, significaría que la materia se estaría creando o destruyendo, lo cual sería imposible según las leyes de la física.
Deja una respuesta